题目内容
【题目】学校化学兴趣小组利用鸡蛋壳(主要成分是碳酸钙)和稀盐酸制取二氧化碳气体,请根据所学化学知识回答下列问题.
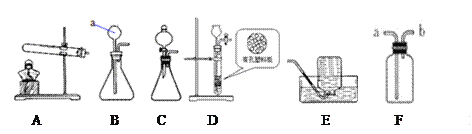
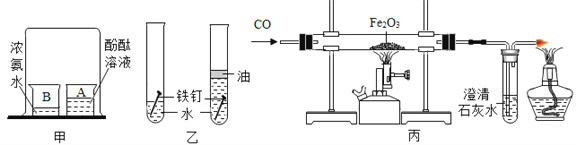
⑴制取二氧化碳的化学方程式为_______________,若要得到平稳的二氧化碳气流,应选择的发生装置是_______________。
⑵装置D也可以用来制备CO2,选择装置D的优点是____。欲收集并测量产生的CO2的体积,可选择F装置,另增加_______(填仪器名称),实验时先在F内装满水,在水面上放一层植物油, CO2应从____(填“a”或“b”)进入F中。若选择F装置检验二氧化碳,则F装置内发生反应的化学方程式 __________。
⑶实验室用氯酸钾和二氧化锰制取氧气时,忘记加入二氧化锰的后果是________,选用装置A、E组合时,摆好铁架台后,接着安装的仪器是_____________。
⑷若实验室制取某气体用E装置收集,请推测该气体的性质:__________(写出一点即可)
【答案】 CaCO3+2HCl===CaCl2+CO2↑+H2O C 控制反应的开始与停止 量筒 b CO2 +Ca(OH)2=== CaCO3↓+H2O 反应速度慢 酒精灯 不溶于水
【解析】⑴根据碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳及分液漏斗能控制液体的流速解答;⑵选择装置D的优点是:控制反应的发生与停止;欲收集并测量产生的CO2的体积,可选择G装置,另增加量筒;实验时先在G内装水,在水面上放一层植物油,CO2应从短管进入,因为二氧化碳的密度比水小;根据检验二氧化碳用澄清的石灰水解答;⑶根据二氧化锰能加快氯酸钾的分解及实验操作顺序解答;⑷根据用排水法收集气体,气体必须不溶或难溶于水解答。⑴制取二氧化碳的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;,若要得到平稳的二氧化碳气流,应选择的发生装置是C;⑵选择装置D的优点是:控制反应的发生与停止;欲收集并测量产生的CO2的体积,可选择G装置,另增加量筒;实验时先在G内装水,在水面上放一层植物油,CO2应从短管(b)进入,因为二氧化碳的密度比水小;检验二氧化碳发生反应的化学方程式为CO2 +Ca(OH)2=CaCO3↓+H2O;⑶实验室用氯酸钾和二氧化锰制取氧气时,忘记加入二氧化锰的后果是反应速度慢,选用装置A、E组合时,摆好铁架台后,接着安装的仪器是酒精灯;⑷若实验室制取某气体用E装置收集,该气体的性质为不溶于水。
【题型】实验题
【结束】
19
【题目】某化学兴趣小组对一包干燥的红色粉末组成进行探究。请你参与并回答问题:
【教师提醒】它由Cu、Fe2O3两种固体中的一种或两种组成
【提出猜想】红色粉末可能的组成:
猜想① 只有Cu; 猜想② ___________;
猜想③ 是Cu、Fe2O3的混合物
【实验探究】
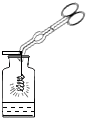
同学们为确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,如图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,继续通CO气体直至玻璃管冷却。
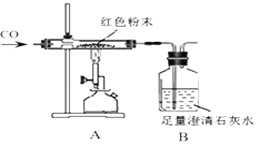
⑴在装置A中先通CO气体的目的是__________________________,A装置中发生反应的化学方程式为__________________________。
⑵小林同学认为为了防止溶液倒吸,本实验停止加热前应先断开A和B的连接,小丽认为不需要,理由是_________________________________。
⑶实验后小组内有同学指出上图装置存在一个缺陷是______________________。
⑷小明同学取少量完全反应后的剩余固体于试管中,加入足量的稀硫酸,观察到有气泡产生,同时试管底部有红色固体。得出的结论是猜想__________成立。
【反思评价】小丁同学通过称量反应前后相关装置和物质的总质量,分析下表中的数据,也能证明猜想。
反应前 | 反应后 |
玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
请通过计算证明哪一个猜想成立?(写出计算过程)___________
【答案】 只有Fe2O3 排尽装置内的空气,防止发生爆炸 3CO+Fe2O3![]() 2Fe+3CO2 实验过程中不断通入一氧化碳 没有对尾气处理 ③ 氧元素质量1.2克;氧化铁的质量为4克,小于5克。故猜想③成立
2Fe+3CO2 实验过程中不断通入一氧化碳 没有对尾气处理 ③ 氧元素质量1.2克;氧化铁的质量为4克,小于5克。故猜想③成立
【解析】【提出猜想】单独的氧化铁也是红色固体。【交流讨论】(1)探究要考虑到CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热;根据一氧化碳在高温的条件下还原氧化铁解答;⑵根据一氧化碳一直向里通入,不会产生倒吸现象解答;⑶根据一氧化碳有毒,排放到空气中会污染空气,因此要进行尾气处理解答;⑷根据实验现象分析解答;【反思评价】计算出固体的氧化铁质量,与混合物质量对比即可确定成分。【提出猜想】由于铜、氧化铁均是红色固体,所以红色粉末可能的组成有:①只有Cu;②只有 Fe2O3;③是Cu、Fe2O3的混合物;【实验探究】⑴根据CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热。所以在装置A中先通CO气体的作用是排尽装置内的空气,防止发生爆炸;A装置中发生反应的化学方程式为Fe2O3+3CO高温2Fe+3CO2;⑵因为在实验过程中不断通入一氧化碳直至冷却,B中溶液不会倒吸到A装置中;⑶此反应应考虑到CO有毒,排放到空气中会污染大气,显然,该装置没有对尾气进行处理;⑷观察到有气泡产生,说明有活泼金属,该活泼金属只可能是铁,即硫酸除去铁锈之后剩余的铁,试管底部有红色固体,此红色固体不与硫酸反应,说明是铜,故猜想③成立;【反思评价】反应前后玻璃管内物质的质量差为氧化铁中减少的氧元素的质量=37.3g-36.1g=1.2g。氧化铁的质量=1.2g÷![]() =4g。粉末共有5g,氧化铁4g,所以含有铜粉,故猜想③成立。
=4g。粉末共有5g,氧化铁4g,所以含有铜粉,故猜想③成立。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】鉴别下列各组物质的方法不正确的是![]()
选项 | 鉴别的物质 | 鉴别的方法 |
A | 冰和干冰 | 室温放置,过一段时间观察是否有液体残留 |
B | 水和过氧化氢溶液 | 加二氧化锰,观察是否有气泡 |
C | 纯水和矿泉水 | 观察是否澄清 |
D | 二氧化碳和一氧化碳 | 点燃,观察是否能燃烧 |
A. A B. B C. C D. D