题目内容
【题目】实验室以氧化铜、铁粉和稀硫酸为原料制备铜。
①方法一:氧化铜  硫酸铜溶液
硫酸铜溶液 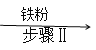 铜
铜
I中反应的化学方程式是 ______;Ⅱ中反应的基本类型是______。该方法利用了铁的金属活动性比铜_______(选填“强”或“弱”)。
②方法二:用铁粉与稀硫酸制得氢气进行如图实验。
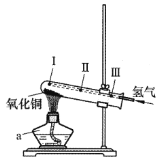
仪器a的名称是______。通入氢气的导管末端应位于试管_______(选填“I”“Ⅱ”或“Ⅲ”)处。该制备铜的方法利用了氢气的 _______ 性。0.1mol氧化铜与足量氢气反应,计算参加反应氢气的质量(根据化学方程式列式计算)________
③通过比较,写出方法一和方法二各自的一条优点。__________
【答案】CuO+ H2SO4 =CuSO4+H2O 置换反应 强 酒精灯 I 还原性 0.2g 方法一节能,方法二较简便
【解析】
①氧化铜与稀硫酸反应生成硫酸铜和水,反应的方程式为:CuO+ H2SO4 =CuSO4+H2O。反应Ⅱ是铁与硫酸铜反应生成铜和硫酸亚铁,该反应是由单质和化合物反应生成单质和化合物,故该反应是置换反应。该方法利用了铁比铜活泼,可以置换出铜。
②仪器a的名称是酒精灯。为了使氢气与氧化铜充分接触,充分反应,故导管要到I处。该反应中,用氢气还原氧化铜,利用了氢气的还原性。
设参加反应的氢气的质量为x
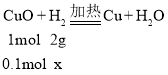
![]() 解得x=0.2g
解得x=0.2g
③方法一节能,方法二较简便。

【题目】甲、乙、丙三种物质间通过一步反应能实现右图转化,下列选项中符合图示转化关系的是
选项 | 甲 | 乙 | 丙 |
A | NaOH | NaCl | NaNO3 |
B | CuO | CuCl2 | Cu(OH)2 |
C | Na2CO3 | CO2 | CaCO3 |
D | H2O2 | H2O | O2 |

A. A B. B C. C D. D
【题目】某密闭容器中有 X、氧气、二氧化碳三种物质,在一定条件下充分反应,反应前后各物质质量的数据记录如下:
物质 | X | O2 | CO2 | H2O |
反应前的质量/g | 46 | 128 | 1 | 0 |
反应后的质量/g | 0 | 待测 | 89 | 54 |
下列判断中,正确的是( )
A. 该反应是分解反应
B. 充分反应后剩余氧气质量为 16 g
C. 生成 CO2与H2O 的质量比是 89:54
D. 物质 X 的化学式为 C2H6O