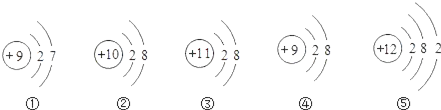
题目内容
【题目】某密闭容器中有 X、氧气、二氧化碳三种物质,在一定条件下充分反应,反应前后各物质质量的数据记录如下:
物质 | X | O2 | CO2 | H2O |
反应前的质量/g | 46 | 128 | 1 | 0 |
反应后的质量/g | 0 | 待测 | 89 | 54 |
下列判断中,正确的是( )
A. 该反应是分解反应
B. 充分反应后剩余氧气质量为 16 g
C. 生成 CO2与H2O 的质量比是 89:54
D. 物质 X 的化学式为 C2H6O
【答案】D
【解析】
由表中数据分析可知,X反应前后的质量减少了46g﹣0g=46g,所以X是反应物,参加反应的质量为46g;同理可以确定二氧化碳是生成物,生成的质量为89g﹣1g=88g;水是生成物,生成的质量为54g﹣0g=54g;由质量守恒定律,氧气应是反应物,且参加反应的质量为88g+54g﹣46g=96g,故X的数值为128g﹣96g=32g。
A、由分析可知,该反应的反应物为X和氧气,生成物是二氧化碳和水,该反应的反应物是两种,不符合“一变多”的形式,不属于分解反应,选项错误;
B、由分析可知,参加反应的氧气的质量为88g+54g﹣46g=96g,充分反应后剩余氧气质量为128g96g=32g,选项错误;
C、由分析可知,生成二氧化碳的质量为89g﹣1g=88g,生成水的质量为54g,所以生成的 CO2与H2O 的质量比是88g:54g=44:27,选项错误;
D、88gCO2中含有碳元素的质量为88g×![]() ×100%=24g,54g水中含有氢元素的质量为54g×
×100%=24g,54g水中含有氢元素的质量为54g×![]() ×100%=6g,生成物88g二氧化碳和54g水中所含碳、氢元素的质量和=124g+6g=30g,30g<46g,所以该物质中一定含有氧元素,且该物质中含氧元素的质量为:46g﹣30g=16g,则该物质分子中碳、氢、氧原子的个数比为
×100%=6g,生成物88g二氧化碳和54g水中所含碳、氢元素的质量和=124g+6g=30g,30g<46g,所以该物质中一定含有氧元素,且该物质中含氧元素的质量为:46g﹣30g=16g,则该物质分子中碳、氢、氧原子的个数比为![]() :
:![]() :
:![]() =2:6:1,物质X的化学式为C2H6O,选项正确,故选D。
=2:6:1,物质X的化学式为C2H6O,选项正确,故选D。

【题目】下表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
⑴影响固体物质溶解度大小的因素有______、______、______。
⑵30℃时KNO3溶液的溶质质量分数的最大值是 _____(只列出表达式)。
⑶90℃时,将一定质量的KNO3溶液按图示进行操作:
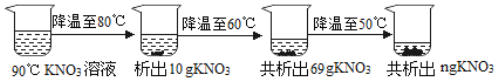
90℃时的KNO3溶液是_______(填“饱和”或“不饱和”)溶液。图中n的数值为______。
⑷30℃时,将等质量10%的KNO3溶液与20%的KNO3溶液混合后,质量分数为_____。