题目内容
【题目】(5分)同学们在学完酸的化学性质后,做了如下实验:
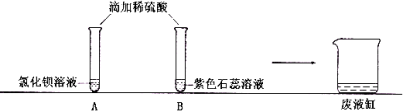
同学们观察到A试管中有(1) 现象。
实验结束,同学们依次将A、B试管中的废液缓慢倒入同一洁净的废液缸中,观察到废液显红色。
为了科学处理实验后产生的废液,同学们决定对废液缸中废液的溶质成分(不考虑石蕊)进行探究。
【查阅资料】钡离子有毒。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】甲同学猜想:废液中只含有HCl [来一种溶质。
乙同学猜想:废液中含有HCl、BaCl2两种溶质。
丙同学的猜想:(2) 。
【表达与交流】甲同学猜想的理由是(3)__________________________________。
【活动与探究】同学们为了验证以上猜想,继续进行实验:
甲同学:取少量废液于试管中,滴加少量的氯化钡溶液,未观察到明显现象。
乙同学:取少量废液于试管中,滴加少量的碳酸钠溶液,看到产生气泡。
丙同学:取少量废液于试管中,滴加少量的硫酸钠溶液,看到产生白色沉淀。
【结论与应用】通过分析甲、乙、丙三位同学们的实验及现象,最终确认(4) (填甲、乙、丙)猜想正确,你认为处理该废液的方法是(5) 。
【答案】(1)产生白色沉淀;(2)HCl、H2SO4 (3)硫酸与氯化钡恰好完全反应生成HCl (4)乙
(5)向废液中滴加硫酸钠溶液至不再产生白色沉淀,向废液中加氢氧化钙(氢氧化钠)溶液至红色变紫色,可倒掉(其他答案合理给分)
【解析】
试题分析:(1)硫酸能与氯化钡反应生成硫酸钡沉淀,故现象是产生白色沉淀;
(2)依次将A、B试管中的废液缓慢倒入同一洁净的废液缸中,观察到废液显红色,说明反应后的溶液呈酸性,那么呈酸性的物质可能只有反应生成的盐酸,若硫酸过量,还可能含有硫酸;若硫酸完全反应了,氯化钡也可能过量,那么反应后的溶液中的溶质存在几种情况:只含有盐酸;是盐酸和硫酸的混合物;是盐酸和氯化钡的混合物;
(3)当硫酸与氯化钡恰好完全反应生成HCl和硫酸钡沉淀,那么溶液中的溶质只有盐酸一种;
(4)根据甲的实验,说明溶液中不含硫酸;根据丙同学的实验操作,说明溶液中含有氯化钡;故反应后的溶液中含有盐酸和氯化钡,乙同学的猜想正确;
(5)根据资料,钡离子有毒,故要把溶液中的钡离子除去,故可向废液中滴加硫酸钠溶液至不再产生白色沉淀,向废液中加氢氧化钙(氢氧化钠)溶液把至红色变紫色,说明氯化钡与硫酸钠完全反应,可倒掉。