题目内容
【题目】溶液在生命活动和生产、生活中都起到十分重要的作用.
(1)将少量下列调味品加入水中,不能形成溶液的是 .
A.食盐 B.蔗糖 C.味精 D.芝麻油
(2)碘酒中的溶剂为 .
(3)在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固体,搅拌至充分溶解得到溶液.加入KNO3固体的质量与所得溶液的质量如下表:
实验编号 | a | b | c | d |
加入KNO3固体的质量/g | 45 | 50 | 55 | 60 |
所得溶液的质量/g | 95 | 100 | 105 | 105 |
①实验a、b、c、d中,所得溶液一定饱和的是 (填写实验编号).
②该温度下,KNO3的溶解度是 g.
③取实验b所得溶液,若使其溶质质量分数变为20%,需加水 g.
(4)在氯化亚铁和氯化铜的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体一定有 ,滤液中一定含有的溶质是 .
【答案】(1)D(2)酒精(或C2H5OH)
(3)①cd;②110; ③150
(4)铜和铁(或Cu和Fe);氯化镁(或MgCl2)
【解析】(1)A、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故A错;
B、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故B错;
C、味精易溶于水,形成均一、稳定的混合物,属于溶液,故C错;
D、芝麻油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故D正确.
(2)碘酒是固态碘的酒精溶液,溶质是碘,溶剂是酒精.
(3)①a、b、c、d实验中向质量均为50g的4份水中分别加入45g、50g、55g、60g的KNO3固体,得到溶液质量分别为95g、100g、105g、105g,可见d有未被溶解的KNO3固体,属于饱和溶液,c55g加入50g水等于105g,刚好饱和.
②根据表格中的实验数据c、d,可知50g水中最多溶解55g硝酸钾,根据溶解度的含义:在该温度下,100g水中最多溶解110g硝酸钾,所以该温度下KNO3的溶解度是110g;
③在不改变温度的情况下,可用加入水的方法降低溶质的质量分数,设加入水的质量为x,![]() ×100%=20%,解得x=150g
×100%=20%,解得x=150g
(4)金属活动性强弱关系镁>铁>氢>铜,向滤出的固体中滴加稀盐酸有气泡产生,可判断滤出固体中含有镁或铁,混合溶液中氯化铜被全部置换,因此,滤出固体中一定含有铜而滤液中无氯化铜,还一定含有能与酸反应制取氢气的铁;滤液中一定含氯化镁,可能含有氯化亚铁

【题目】根据如图所示装置回答问题:
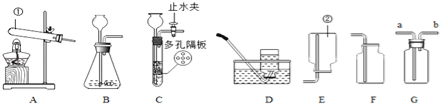
(1)写出下列仪器的名称:① ② .
(2)实验室若用B装置来制取二氧化碳,应往长颈漏斗中入 ,若用G装置来收集二氧化碳,二氧化碳应从 进入(选“a”或“b”).如果选择装置C制取二氧化碳,与B装置相比,其优点是: .
(3)用不加催化剂的方法制取氧气,选择的发生装置是 ,反应的化学方程式 ;若选择G装置(事先装满水)收集氧气,则氧气应从 通入(选“a”或“b”).
(4)某化学兴趣小组欲测定一块石灰石样品中碳酸钙的质量分数(假设样品中的杂质不溶于水也不与盐酸反应).将15.0g石灰石样品放入烧杯中,再取100g稀盐酸分4次加入烧杯中,每次均充分反应.实验数据记录如下:
次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | m | 61.4 | 85.6 | 110.6 |
试计算:
①生成二氧化碳的总质量 g
②第1次加入稀盐酸充分反应后,烧杯中物质的总质量m为
③该石灰石样品中碳酸钙的质量分数(写出计算过程).