题目内容
【题目】根据如图所示装置回答问题:
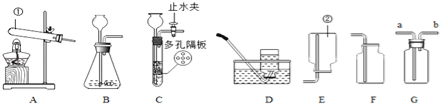
(1)写出下列仪器的名称:① ② .
(2)实验室若用B装置来制取二氧化碳,应往长颈漏斗中入 ,若用G装置来收集二氧化碳,二氧化碳应从 进入(选“a”或“b”).如果选择装置C制取二氧化碳,与B装置相比,其优点是: .
(3)用不加催化剂的方法制取氧气,选择的发生装置是 ,反应的化学方程式 ;若选择G装置(事先装满水)收集氧气,则氧气应从 通入(选“a”或“b”).
(4)某化学兴趣小组欲测定一块石灰石样品中碳酸钙的质量分数(假设样品中的杂质不溶于水也不与盐酸反应).将15.0g石灰石样品放入烧杯中,再取100g稀盐酸分4次加入烧杯中,每次均充分反应.实验数据记录如下:
次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | m | 61.4 | 85.6 | 110.6 |
试计算:
①生成二氧化碳的总质量 g
②第1次加入稀盐酸充分反应后,烧杯中物质的总质量m为
③该石灰石样品中碳酸钙的质量分数(写出计算过程).
【答案】(1)试管,集气瓶;
(2)稀盐酸,a,可以控制反应的发生和停止;
(3)A,2KMnO4![]() K2MnO4+MnO2+O2↑,b;
K2MnO4+MnO2+O2↑,b;
(4)①4.4;②m=38.2;③石灰石样品中碳酸钙的质量分数为66.7%.
【解析】(1)通过分析题中所指仪器的作用可知,①是试管,②是集气瓶;
(2)碳酸钙和盐酸反应制取二氧化碳时,应往长颈漏斗中入稀盐酸,二氧化碳密度比空气大,所以用G装置来收集二氧化碳,二氧化碳应从a进入,选择装置C制取二氧化碳,与B装置相比,其优点是:可以控制反应的发生和停止;
(3)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,所以选择的发生装置是A,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑,氧气密度比水小,不易溶于水,所以选择G装置(事先装满水)收集氧气,则氧气应从b通入;
K2MnO4+MnO2+O2↑,氧气密度比水小,不易溶于水,所以选择G装置(事先装满水)收集氧气,则氧气应从b通入;
(4)①生成二氧化碳的质量为:15g+100g﹣110.6g=4.4g;
②通过表中数据可知,第三次加入稀盐酸后,反应后烧杯中物质的总质量仍然减少,说明第1、2次反应中,碳酸钙足量,与稀盐酸反应生成的二氧化碳质量相等,第1、2次生成的二氧化碳质量为:15.0g+50g﹣61.4g=3.6g,每次生成的二氧化碳质量为1.8g,所以m的值是:25g+15g﹣1.8g=38.2g;
③设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
![]() =
=![]()
x=10g
碳酸钙的质量分数为:![]() ×100%=66.7%.
×100%=66.7%.

【题目】某实验小组想测定黄铜中铜的质量分数,实验数据记录如下:
样品 | 实验1 | 实验2 | 实验3 | 实验4 | 实验5 |
黄铜质量\g | 40 | 40 | 40 | 40 | 40 |
加入稀硫酸质量\g | 30 | 60 | 90 | 120 | 150 |
生成气体质量\g | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
(1)根据实验数据分析,从实验 开始金属已经完全反应.
(2)计算黄铜中铜的质量分数.(精确到0.1%)
(3)计算所用稀硫酸的溶质质量分数.(精确到0.1%)
【题目】溶液在生命活动和生产、生活中都起到十分重要的作用.
(1)将少量下列调味品加入水中,不能形成溶液的是 .
A.食盐 B.蔗糖 C.味精 D.芝麻油
(2)碘酒中的溶剂为 .
(3)在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固体,搅拌至充分溶解得到溶液.加入KNO3固体的质量与所得溶液的质量如下表:
实验编号 | a | b | c | d |
加入KNO3固体的质量/g | 45 | 50 | 55 | 60 |
所得溶液的质量/g | 95 | 100 | 105 | 105 |
①实验a、b、c、d中,所得溶液一定饱和的是 (填写实验编号).
②该温度下,KNO3的溶解度是 g.
③取实验b所得溶液,若使其溶质质量分数变为20%,需加水 g.
(4)在氯化亚铁和氯化铜的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体一定有 ,滤液中一定含有的溶质是 .
【题目】如图所示装置是初中化学的常见装置,用该装置可以完成不同的实验.
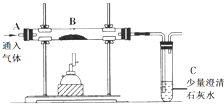
(1)探究燃烧条件:若B处盛放木炭.
Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
①能说明可燃物燃烧需要氧气的实验是 (填实验序号).
②Ⅲ中石灰水变浑浊的反应方程式为
(2)模拟工业炼铁:若B处盛放赤铁矿粉末,利用一氧化碳进行还原.
①经检查装置气密性良好.为了防止爆炸,在用酒精喷灯给B处加热前应该先 ,点燃酒精喷灯一段时间后,B处可观察到的现象为 .
②某同学为了测定该赤铁矿石中氧化铁的质量分数,他称取了一定质量的赤铁矿石粉末,并通过正确的实验操作获得了如下数据:
反应前 | 完全反应后 | |
方法1 | 玻璃管和赤铁矿粉末的总质量为m1 | 玻璃管和固体物质的总质量为m2 |
方法2 | 试管和石灰水的总质量为m3 | 试管和试管中物质的总质量为m4 |
你认为他应该选择方法 (填“1”或“2”)的实验数据来计算赤铁矿石中氧化铁质量分数,结果才更准确.
③用上述装置完成炼铁实验,有一明显不足,请改进 .