题目内容
【题目】(7分)四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表所示。
Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀的pH | 5.7 | 7.6 | 10.4 |
沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
(3)制备Fe3O4的实验流程如下:
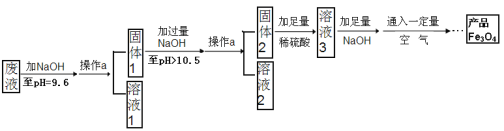
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为 (写出其中一个)。
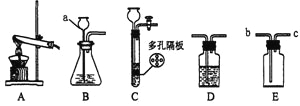
(2)操作a的名称为 。该操作需要的玻璃仪器有烧杯、玻璃棒、 等。玻璃棒在此操作中的主要作用是 。
(3)溶液1所含溶质有 (至少写两种成分的化学式);溶液3所含溶质的主要成分为 (写名称)。
【答案】(1) 2NaOH+ZnSO4==Zn(OH)2↓ +Na2SO4或 2NaOH+FeSO4==Fe(OH)2↓ +Na2SO4
(2) 过滤 漏斗 引流,防止液滴飞溅
(3) Na2SO4、NaOH、MgSO4中的两种 硫酸亚铁
【解析】
试题分析:(1)往废液中加入氢氧化钠溶液,且控制PH=9.6,结合氢氧化物沉淀的pH范围,Mg(OH)2开始沉淀的PH为10.4,所以不会沉淀,故往废液中加入氢氧化钠溶液生成沉淀的化学方程式为:2NaOH+ZnSO4==Zn(OH)2↓ +Na2SO4或 2NaOH+FeSO4==Fe(OH)2↓ +Na2SO4
(2)操作a是将固体与液体分离,是过滤操作,该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,玻璃棒在此操作中的主要作用是:引流,防止液滴飞溅
(3)溶液1是发生了反应:2NaOH+ZnSO4==Zn(OH)2↓ +Na2SO4和 2NaOH+FeSO4==Fe(OH)2↓ +Na2SO4,所以Na2SO4一定含有,而MgSO4没有参加反应,再加上NaOH可能过量,所以溶液1所含溶质有:Na2SO4、NaOH、MgSO4中的两种;固体1含有两种沉淀Zn(OH)2和=Fe(OH)2,继续加过量的NaOH,并且控制PH>10.5,根据25℃时,Zn(OH)2可溶于pH>10.5的碱溶液,所以固体2中就只含有Fe(OH)2,加入足量的稀硫酸,发生反应:Fe(OH)2+H2SO4==FeSO4↓+2H2O,故溶液3所含溶质的主要成分为硫酸亚铁

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】 KNO3和KCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
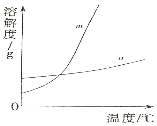
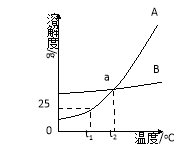
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,上图中能表示KNO3溶解度曲线的是 ① 。(填m或n)
(2)由表中数据分析可知, KNO3和KCl在某一温度时具有相同的溶解度x,则x的值是 ① 。
(3)如下图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的___①_____(填字母序号)。
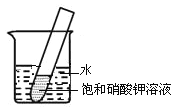
A.氢氧化钠固体 B.生石灰固体 C.冰块 D.硝酸铵固体 E.浓硫酸