题目内容
【题目】根据下列装置,结合所学化学知识回答下列问题:
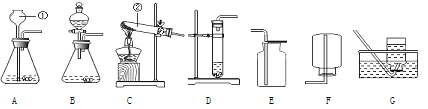
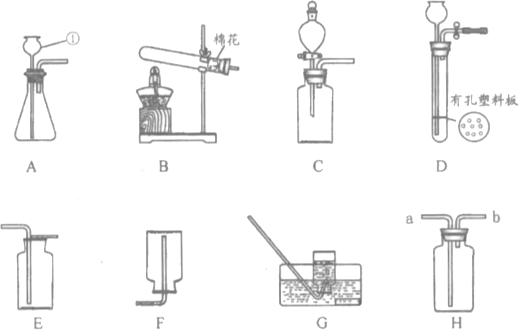
(1)写出图中标号仪器的名称:②___________;
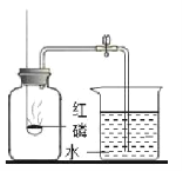
(2)实验室用双氧水和二氧化锰制取氧气时,收集装置选用___,能用此收集方法的原因是______________,写出该反应的文字表达式__________________________,二氧化锰是该反应的__________。
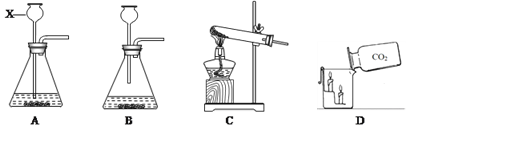
(3)实验室用高锰酸钾制取氧气时,发生装置应选用__________(填字母);其反应的文字表达式__________________________,二氧化锰是该反应的_____。
(4)如用G装置收集氧气,开始收集的最佳时刻是___________________;
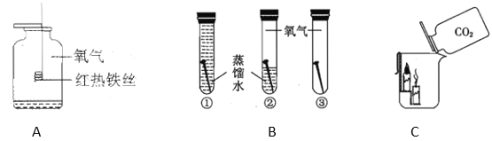
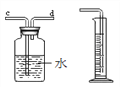
(5)为了测量生成氧气的体积可用下图装置,氧气从__________端进入(填序号),量筒的作用是______________________。
【答案】 试管 E或G 密度比空气大(或不易溶于水) 过氧化![]() 氢水+氧气 催化剂 C 高锰酸钾
氢水+氧气 催化剂 C 高锰酸钾![]() 锰酸钾+二氧化锰+氧气 生成物 当气泡连续均匀冒出时,开始收集 d 测量排出水的体积
锰酸钾+二氧化锰+氧气 生成物 当气泡连续均匀冒出时,开始收集 d 测量排出水的体积
【解析】(1)根据常见仪器解答;
(2)根据气体收集方法的选择根据、反应原理分析解答;
(3)根据制取气体装置的选择根据、反应原理分析解答;
(4)根据用排水法开始收集氧气的适宜时刻是:当气泡连续均匀冒出时,开始收集解答;
(5)根据反应生成多少体积的氧气,就有多少体积的水进入量筒中分析解答。
解:(1) 图中标号仪器的名称为②试管;
(2)氧气的密度比空气大,可用向上排空气法收集,氧气不易溶于水,可用排水法收集,故实验室用双氧水和二氧化锰制取氧气时,收集装置选用E或G;过氧化氢在二氧化锰的催化作用下分解为水和氧气,反应的文字表达式为:过氧化氢![]() 水+氧气;二氧化锰是该反应的催化剂;
水+氧气;二氧化锰是该反应的催化剂;
(3) 实验室用高锰酸钾制取氧气应选择固体加热型装置,故选择:C;高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,反应的文字表达式为:高锰酸钾![]() 锰酸钾+二氧化锰+氧气;二氧化锰是该反应的生成物;
锰酸钾+二氧化锰+氧气;二氧化锰是该反应的生成物;
(4)如用排水法收集氧气,开始收集的最佳时刻是:当气泡连续均匀冒出时,开始收集;
(5) 为了测量生成氧气的体积可用下图装置,氧气从d端进入,因为氧气的密度比水小,量筒的作用是:测量排出水的体积,从而得出收集的氧气的体积。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】下列归纳和总结完全正确的一组是![]()
![]()
A.对鉴别的认识 | B.化学与生活 |
|
|
C.化学与资源 | D.化学与安全 |
|
|
A. AB. BC. CD. D
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用下图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
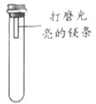
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水再通入约4mL CO2 | 镁条第3天开始变黑至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是 (用化学方程式表示)。
(2)实验1的目的是 。
(3)实验3中,试管内的气体主要含有CO2、 。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是 (填编号)。
(5)由上述实验可推知,镁条变黑的条件是 。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是 。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是 。