题目内容
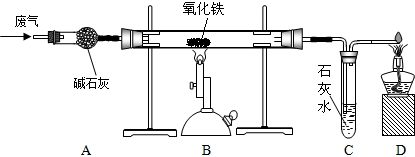
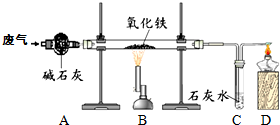
(5分)某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按下图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕。
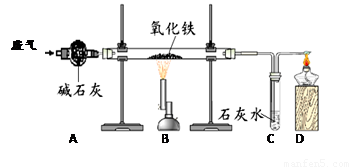
(1)A中碱石灰的作用是___________________________。
(2)B中发生反应的化学方程式是______________________________________。
(3)该实验能证明混合气体中存在CO的现象是 。
(4)若反应前称得硬质玻璃管内的氧化铁质量为10克,反应一段时间后冷却再次称量发现硬质玻璃管内的固体质量变为7.6克,则反应了的氧化铁的质量分数为____________。
⑴除去废气中的水和二氧化碳
⑵3CO + Fe2O3 高温 2Fe+3CO2
⑶ B中红褐色粉末变黑;C中石灰水有气泡产生且变浑浊。(本题2分,答对一个现象得1分)
⑷ 80%
【解析】
试题分析:(1)由题意可知,A中碱石灰的作用是除去废气中的水和二氧化碳;
(2)B中是一氧化碳和氧化铁在反应,发生反应的化学方程式是3CO + Fe2O3 高温 2Fe+3CO2 ;
(3)若B中红褐色粉末变黑,C中石灰水有气泡产生且变浑浊,则能证明混合气体中存在CO;
(4)由题意可知,反应一段时间后冷却再次称量发现硬质玻璃管内的固体质量变为7.6克,则固体减少的质量应该是反应掉的氧化铁中氧元素的质量。设,反应掉的氧化铁的质量为X。
X·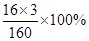 =10-7.6,X=8g,故反应了的氧化铁的质量分数为
=10-7.6,X=8g,故反应了的氧化铁的质量分数为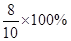 =80%。
=80%。
考点:物质检验;除杂;化学方程式;化合物中元素的质量分数。
点评:检验物质,可以通过特定的实验现象来确定;书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号;某元素的质量分数=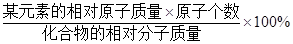 。
。