题目内容
【题目】氯化钠是一种重要的化工原料.电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,现取一定质量的质量分数为10%的NaCl溶液进行电解,当氯化钠完全反应时,停止通电,生成氯气的质量与时间的关系如图所示.请计算:
Cl2↑+H2↑+2NaOH,现取一定质量的质量分数为10%的NaCl溶液进行电解,当氯化钠完全反应时,停止通电,生成氯气的质量与时间的关系如图所示.请计算:
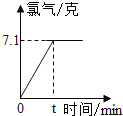
(1)参加反应的氯化钠是多少克______?生成氢气多少______?
(2)完全反应后所得溶液中溶质的质量分数是多少______?
【答案】11.7克 0.2克 7.3%
【解析】
(1)题干中有NaCl溶液电解的化学方程式,根据方程式由图中所给的氯气质量可直接求出参加反应的NaCl质量和H2质量;
(2)根据NaCl溶液电解的化学方程式,利用氯气质量可得到生成的氢氧化钠的质量,进而求出氢氧化钠的质量分数。
解:(1)设参加反应的NaCl的质量为x,生成H2的质量为y,生成的NaOH的质量为z,

![]() x=11.7g,
x=11.7g,
![]() y=0.2g,
y=0.2g,
![]() z=8g,
z=8g,
(2)氯化钠溶液质量为11.7g÷10%═117g,完全反应后NaOH溶液中NaOH的质量分数为:![]() ×100%≈7.3%,
×100%≈7.3%,
答:(1)参加反应的氯化钠是11.7克,生成的氢气是0.2克;
(2)完全反应后所得溶液中溶质的质量分数约是7.3%。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】小苏打的主要成分是碳酸氢钠,如图1是一包某品牌小苏打的标签信息。
学校化学兴趣小组的同学取少量该小苏打样品通过实验来测定某稀盐酸溶质的质量分数,同时测定该小苏打样品达到的质量标准。兴趣小组分四次往盛有50g稀盐酸的烧杯里依次加入等质量的小苏打(如图1,其中烧杯质量为100g),充分搅拌后读取电子秤显示的读数,并将数据记录如下表。
次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入小苏打样品的质量/g | 5 | 5 | 5 | 5 |
电子秤显示的读数/g | 152.4 | 154.8 | 157.2 | 162.2 |
请结合表中数据完成以下计算并回答问题(杂质不与盐酸反应)

(1)请在图2坐标中画出加入小苏打样品的质量与产生气体总质量的曲线图_____。
(2)所加稀盐酸的溶质质量分数是多少(写出计算过程,精确到0.1%)_____?
(3)小苏打中碳酸氢钠质量分数≥99.5%为优等品,达到98.2%为一等品。请计算判断该小苏打样品达到_____(填“优等品”或“一等品”)标准。从标签信息可以知道保存小苏打的方法是_____。