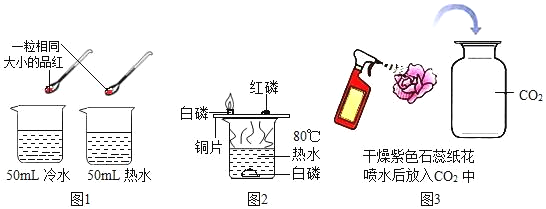
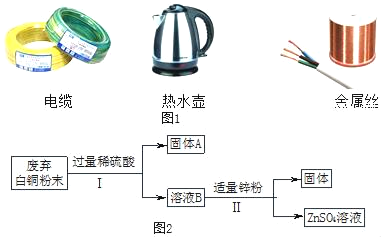
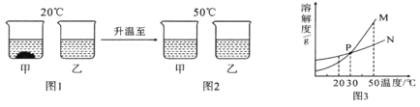
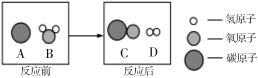
题目内容
【题目】元素周期表是化学学习的重要工具,依据下表回答问题:
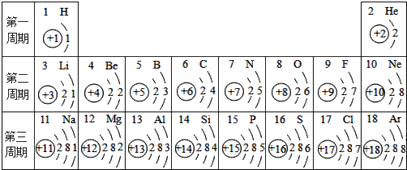
(1)表中16号元素属于______(填“金属”或“非金属”)元素,在化学反应中比较容易_____(填“失去”或“得到”)电子,形成_____(填离子符号),该元素的化学性质与表中______元素相似。
(2)由11号元素与17号元素组成的常见物质的名称是______。
(3)根据上表中原子核外电子排布规律,原子序数为20元素的原子结构示意图为______,该元素的原子在化学反应中容易形成离子,该离子符号是______.
(4)表中同一周期原子的核外电子排布规律是_______________________。
【答案】非金属 得到 S2- 氧 氯化钠 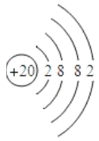 Ca2+ 由左至右,原子的最外层电子数依次增1
Ca2+ 由左至右,原子的最外层电子数依次增1
【解析】
(1)由图可知,16号元素为硫元素,该元素名称带有石字旁,属于非金属元素,故填非金属;
由硫原子结构示意图可知,硫原子的最外层电子数为6,在化学反应中易得到电子,故填得到;
一个硫原子在化学反应中能得到2个电子,形成带2个单位负电荷的硫离子,根据离子符号的写法:在相应元素符号的右上角先写出所带电荷的数目,再写出电荷的电性,则硫离子的符号为S2-,故填S2-;
硫原子与表中氧原子的最外层电子数都为6,所以硫元素与氧元素的化学性质相似,故填氧。
(2)11号元素为钠元素,17号元素为氯元素,这两种元素组成的化合物的名称是氯化钠,故填氯化钠。
(3)依照表中原子核外电子排布规律,原子序数为20元素的原子核外有4个电子层,第一层有2个电子,第二层有8个电子,第三层有8个电子,第四层有2个电子,所以该元素原子的结构示意图为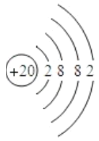 ;
;
20号元素为钙元素,钙原子的最外层电子数为2,在化学反应中易失去这两个电子,形成带2个单位正电荷的钙离子,根据离子符号的写法:在相应元素符号的右上角先写出所带电荷的数目,再写出电荷的电性,则钙离子的符号为Ca2+,故填Ca2+。
(4)同一周期原子就是元素周期表中同一横行中的元素原子,由图可知,表中同一周期原子的核外电子排布规律是由左至右,原子的最外层电子数依次增1,故填由左至右,原子的最外层电子数依次增1。

【题目】某化学小组在探究碱的化学性质时,做了如图所示的两个实验。
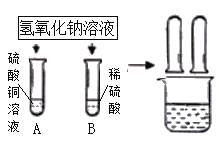
(1)写出A试管中发生反应的化学方程式________。
(2)实验结束后,同学们将A、B两试管中的废液倒入同一洁净的烧杯,烧杯中出现蓝色沉淀.小组同学将烧杯中的物质进行了过滤,对滤液中成分有如下猜想:
(提出猜想)甲:滤液中的溶质是Na2SO4
乙:滤液中的溶质是Na2SO4 、 H2SO4
丙:滤液中的溶质是Na2SO4 、 CuSO4
丁:滤液中的溶质是______
(交流讨论)同学们对以上的猜想提出质疑,认为猜想______不合理,理由是______
(设计实验)同学们通过以下的实验对猜想进行验证,请你完成实验报告。
实验内容 | 预计现象 | 预计结论 |
①取少量滤液于试管中,观察 | 溶液呈无色 | 猜想_____不成立 |
②继续在上述试管中加入______ | ______ | 猜想丁成立 |