题目内容
【题目】(1)橘子是我们常吃的一种水果。剥开橘皮,会闻到橘子香甜的气味,说明粒子具有的性质_________;橘子中含有人体所需的营养素有__________(填写一种);橘子中含一种化学式为C6H8O6的物质,该物质中碳、氢、氧的质量比_________;橘子中钙元素是骨骼与牙齿的主要成分。钙元素的部分信息如下图,则下列说法中正确的是___________。

A、钙原子中的核外电子数为20
B、一个钙原子中有40个中子
C、钙离子核外电子层数为四
D、钙离子带两个单位正电荷
(2)碳酸氢钠、氧气是我们身边常见的物质,有着广泛的用途。
①氧气常用于气焊、供呼吸、助燃等,是因为氧气具有________________的性质。
②碳酸氢钠是发酵粉的成分之一,其俗称是___________,碳酸氢钠用于治疗胃酸过多症,其原因是______(用化学方程式表示)
(3)近日国产某品牌压力IH电饭煲,在硬件性能上打破了日本电饭煲在高端市场的垄断,使国人爱上中国造。如图为该品牌电饭煲实物图,请回答下列问题:

所标物质中,属于有机合成材料的是______(填一种序号即可);塑料防堵罩应使用_______(填“热塑性”或“热固性”)较好的塑料。
【答案】不断运动; 糖类、维生素、水、无机盐; 72:8:96或9:1:12; A、D 氧化性 小苏打 NaHCO3+HCl=NaCl+H2O+CO2↑ ①③; 热固性
【解析】
本题考查了分子的性质、食物中的营养素、根据化学式的计算、元素周期表的信息,碳酸氢钠、氧气的性质,材料的分类等知识
(1)剥开橘皮,会闻到橘子香甜的气味,说明分子在不断运动;由题干的信息可知,其中富含糖类、维生素、水和无机盐;在维生素C中,碳、氢、氧三种元素质量比为(12×6):(1×8):(16×6)=72:8:96=9:1:12;A、在原子中,原子序数=核电荷数=质子数=核外电子数,钙原子的原子序数为20,核外有20个电子,正确;B、在原子中,原子序数=核电荷数=质子数=核外电子数,钙原子的原子序数为20,核内有20个质子,相对原子质量=中子数+质子数,一个钙原子的中子数=40-20=20,错误;C、根据原子结构示意图,钙离子核外电子层数为四,正确;C、钙原子有4个电子层,最外层有2个电子,在化学变化中,易失去最外层的2个电子,形成有三个电子层的钙离子,错误;D、钙原子有4个电子层,最外层有2个电子,在化学变化中,易失去最外层的2个电子,而形成带两个单位正电荷的钙离子,正确。故选AD;
(2)①氧气常用于气焊、供呼吸、助燃等,是因为氧气具有氧化性的性质;
②碳酸氢钠俗称小苏打,碳酸氢钠和盐酸反应生成物是氯化钠、水、二氧化碳,化学方程式是:NaHCO3+HCl=NaCl+H2O+CO2↑;
(3)属于有机合成材料的是橡胶密封圈、塑料防堵罩,故答案为①或③;塑料防堵罩使用的是热固性较好的塑料。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O===2NaOH+H2↑。在实验室,某同学先取50 mL一定质量分数的硫酸铜溶液于烧杯中,再取绿豆大小的钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤液的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性。
(猜想与假设)
猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:Na2SO4和CuSO4
猜想四:Na2SO4、CuSO4和NaOH
其中猜想不合理的是________,理由是________(用化学方程式表示)。
(实验方案与验证)
实验 | 实验操作 | 实验现象 | 实验结论 |
实验一 | 取少量滤液于试管中,观察现象 | 溶液为无色 | 猜想___不成立 |
实验二 | 另取少量滤液于试管中,向其中 加入__________ | 无明显现象 | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液 酸碱度 | pH=7 | 猜想____成立 |
(拓展延伸)
(1)将2.3g金属钠与足量水反应,可得到氢氧化钠______g。
(2)金属钠在保存中应注意的是_______。
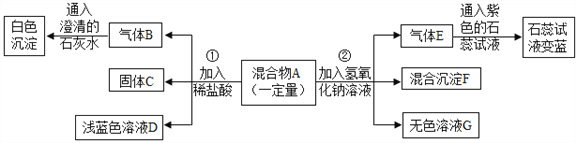
【题目】某化学活动小组合作学习氢氧化钠和氢氧化钙的相关知识。
[活动1]下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |

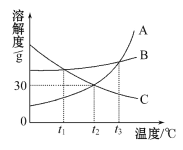
(1)依据上表数据,绘制了Ca(OH)2和NaOH的溶解度曲线,右图中能表示NaOH溶解度曲线的是_________(填“A”或“B”);
(2)将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:①加入氢氧化钙A B②升高温度 ③降低温度 ④加入水 ⑤蒸发水后再恢复到原温度 ⑥加入生石灰。其中措施正确的是_______(填字母);
A、②④⑥ B、③④ C、①③⑤⑥ D、①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体。这时溶液的质量分数为____________;
(4)现有20℃时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时溶液中溶质的质量乙_______(填“>”或“<”“=”)甲;
[活动2]20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH_________________(填“偏大”或“偏小”“不受影响”)。
[活动3]用化学方法鉴别氢氧化钠溶液和澄清石灰水实验方案为___________。