题目内容
(2008?丰台区二模)金属是一类重要的材料,人类的生活和生产都离不开金属.(1)钛合金是21世纪的重要材料,具有熔点高、可塑性好、抗腐蚀性强、与人体有很好的“相容性”等优良性能.金属的下列用途:①用来做保险丝 ②用来制人造骨 ③用于制造船舶 ④用于制造航天飞机.其中与钛合金性能符合的是(填序号).
(2)金属锂(元素符号为Li)的化合物氢氧化锂[LiOH]是一种易溶于水的白色固体,具有强碱性.载人航天飞船中通常用LiOH代替NaOH来吸收航天员呼吸产生的CO2,则LiOH与CO2反应的化学方程式.
(3)小琴同学设计如下图所示的A、B两个实验.她事先除去了铁丝和银丝表面的氧化物或污物.
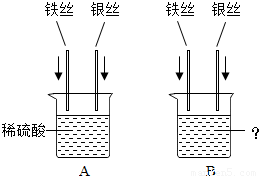
①做A实验时,将铁丝和银丝同时插入稀硫酸中,所发生反应的化学方程式为,其实验目的是;
②B实验中,当烧杯内盛有溶液时,可验证Fe、、Ag三种金属活动性强弱.
【答案】分析:(1)利用钛合金的熔点高、可塑性好、抗腐蚀性强、与人体有很好的“相容性'性质,与金属的用途相对应,可得答案.
(2)结合氢氧化钠与二氧化碳反应的方程式进行书写即可.
(3)①由金属活动性顺序表可知铁能与硫酸反应而银不能.
②要检验铁银及盐中的金属活动性的强弱,可选择硫酸铜的溶液.
解答:解:(1)利用钛合金的熔点高、可塑性好、抗腐蚀性强、与人体有很好的“相容性”性质,与金属的用途相对应,
①用来做保险丝,无对应关系②用来制人造骨,对应与人体有很好的相容性③用于制造船舶,对应耐腐蚀性④用于制造航天飞机,对应熔点较高.
故答案为:②③④
(2)结合氢氧化钠与二氧化碳反应的产物是碳酸钠与水的知识解决.
故答案为:2LiOH+CO2=Li2CO3+H2O
(3)①由金属活动性顺序表可知铁能与硫酸反应而银不能.
故答案为:Fe+H2SO4=FeSO4+H2↑;检验哪种金属能与酸反应(比较铁和银的相对活泼性)
②要检验铁、银及盐中的金属活动性的强弱,可选择硫酸铜的溶液,证明铁、银、及铜的活动性强弱.
故答案为:CuSO4;Cu.
点评:此题是关于金属知识的考查,解决的关键是结合常见金属的性质对新的知识进行探讨,主要有利用钛合金信息解决用途,利用氢氧化钠与氢氧化锂的类比,解决其与二氧化碳的反应,根据金属活动性顺序解决相关的实验解释,属基础性知识考查题.
(2)结合氢氧化钠与二氧化碳反应的方程式进行书写即可.
(3)①由金属活动性顺序表可知铁能与硫酸反应而银不能.
②要检验铁银及盐中的金属活动性的强弱,可选择硫酸铜的溶液.
解答:解:(1)利用钛合金的熔点高、可塑性好、抗腐蚀性强、与人体有很好的“相容性”性质,与金属的用途相对应,
①用来做保险丝,无对应关系②用来制人造骨,对应与人体有很好的相容性③用于制造船舶,对应耐腐蚀性④用于制造航天飞机,对应熔点较高.
故答案为:②③④
(2)结合氢氧化钠与二氧化碳反应的产物是碳酸钠与水的知识解决.
故答案为:2LiOH+CO2=Li2CO3+H2O
(3)①由金属活动性顺序表可知铁能与硫酸反应而银不能.
故答案为:Fe+H2SO4=FeSO4+H2↑;检验哪种金属能与酸反应(比较铁和银的相对活泼性)
②要检验铁、银及盐中的金属活动性的强弱,可选择硫酸铜的溶液,证明铁、银、及铜的活动性强弱.
故答案为:CuSO4;Cu.
点评:此题是关于金属知识的考查,解决的关键是结合常见金属的性质对新的知识进行探讨,主要有利用钛合金信息解决用途,利用氢氧化钠与氢氧化锂的类比,解决其与二氧化碳的反应,根据金属活动性顺序解决相关的实验解释,属基础性知识考查题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(2008?丰台区二模)食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠.为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的同学进行了如下实验:(反应过程中不考虑水和氯化氢的挥发.)
甲组同学:称取12.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
(1)请你分别用甲组和乙组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.
(2)计算乙组实验时所用稀盐酸中溶质的质量分数.
甲组同学:称取12.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.90 | 97.80 | 116.70 | 135.60 | 155.05 | 175.05 | 195.05 |
(2)计算乙组实验时所用稀盐酸中溶质的质量分数.
(2008?丰台区二模)某化学小组同学用一氧化碳还原氧化铁后的剩余固体做探究实验,过程如下:
(提出问题)该固体的成分是什么?
(查阅资料)①铁和硫酸铁反应的化学方程式是:Fe+Fe2(SO4)3═3FeSO4
②Fe2(SO4)3溶液为黄色,FeSO4溶液为浅绿色.
(作出猜想)该固体中含有铁粉和氧化铁
同学们猜想该固体含有氧化铁的依据是______.
(设计实验)
(同学们想计算)2g样品中氧化铁的质量分数,请你帮助他们想一想用“固体减重”还是用“石灰水增重”计算更为准确?______.理由是______.
(提出问题)该固体的成分是什么?
(查阅资料)①铁和硫酸铁反应的化学方程式是:Fe+Fe2(SO4)3═3FeSO4
②Fe2(SO4)3溶液为黄色,FeSO4溶液为浅绿色.
(作出猜想)该固体中含有铁粉和氧化铁
同学们猜想该固体含有氧化铁的依据是______.
(设计实验)
| 实验操作 | 实验现象 | 结论及相关化学方程式 | |
| 验证猜想 | 实验①取2g样品,放入玻璃管中,如图连接仪器,进行实验. 实验完毕,再称固体质量 | 现象一:____________ . 现象二: 反应后固体质量为1.88g,澄清石灰水增重0.3g | |
| 实验②另取2g样品放入试管中,加入少量稀硫酸. | 现象一:____________ ; 现象二: 生成浅绿色溶液. | ||
| 综合分析实验①、②现象,得出结论:猜想正确 | |||





