题目内容
(2008?丰台区二模)食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠.为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的同学进行了如下实验:(反应过程中不考虑水和氯化氢的挥发.)甲组同学:称取12.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.90 | 97.80 | 116.70 | 135.60 | 155.05 | 175.05 | 195.05 |
(2)计算乙组实验时所用稀盐酸中溶质的质量分数.
【答案】分析:(1)样品中碳酸钠的质量分数= ×100%,需要计算样品中碳酸钠的质量;甲组可根据生成的碳酸钙的质量计算参加反应的碳酸的质量,乙组则可根据完全反应放出二氧化碳的质量计算参加反应的碳酸钠的质量;
×100%,需要计算样品中碳酸钠的质量;甲组可根据生成的碳酸钙的质量计算参加反应的碳酸的质量,乙组则可根据完全反应放出二氧化碳的质量计算参加反应的碳酸钠的质量;
(2)乙组实验时所用稀盐酸中溶质的质量分数= ×100%;
×100%;
根据实验数据,找出盐酸完全反应的实验数据,由放出二氧化碳的质量计算反应消耗盐酸的质量;
由于前4次实验数据间的差值都可知,前四次实验放出二氧化碳的质量均为1.1g,说明前四次实验中所加稀盐酸都完全反应,因此在计算盐酸质量时,可使用前四次的数据进行计算.
解答:解:(1)甲组:设12g样品中碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x10g
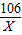 =
=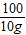
x═10.6g
样品中Na2CO3%= =100%=88.3%;
=100%=88.3%;
乙组:由表中数据可知,从第6次加入稀盐酸后质量不在减少,说明第5次碳酸钠已完全反应.
第2次加入盐酸20g后,溶液增重的质量为(97.8g-78.9g)=18.9g,则减少的质量为生成二氧化碳的质量,由此可得加入20克稀盐酸可以生成二氧化碳的质量为20g-(97.8g-78.9g)=1.1g;
第5次加入盐酸后生成二氧化碳的质量为:20g-(155.05g-135.60g)=0.55g;
则加入5次盐酸后生成二氧化碳的总质量为:1.1g+1.1g+1.1g+1.1g+0.55g=4.95g
设13.5g样品中碳酸钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
y 4.95g
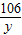 =
=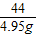 y=11.925g
y=11.925g
样品中Na2CO3%=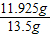 =88.3%;
=88.3%;
(2)生成二氧化碳的质量为:20g-(97.8g-78.9g)=1.1g
设20g盐酸中氯化氢的质量是z
Na2CO3+2HCl═2NaCl+CO2↑+H2O
73 44
z 1.1g
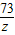 =
=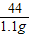 z═1.825g
z═1.825g
该稀盐酸中溶质的质量分数=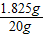 ×100%=9.1%;
×100%=9.1%;
答:(1)甲组和乙组同学的实验结果,样品中碳酸钠的质量分数均为88.3%;
(2)乙组实验时所用稀盐酸中溶质的质量分数为9.1%.
点评:使用第2次实验数据计算时,产生二氧化碳的质量1.1g×2=2.2g,稀盐酸的质量20g×2=40g,第3、4次实验依此类推.
 ×100%,需要计算样品中碳酸钠的质量;甲组可根据生成的碳酸钙的质量计算参加反应的碳酸的质量,乙组则可根据完全反应放出二氧化碳的质量计算参加反应的碳酸钠的质量;
×100%,需要计算样品中碳酸钠的质量;甲组可根据生成的碳酸钙的质量计算参加反应的碳酸的质量,乙组则可根据完全反应放出二氧化碳的质量计算参加反应的碳酸钠的质量;(2)乙组实验时所用稀盐酸中溶质的质量分数=
 ×100%;
×100%;根据实验数据,找出盐酸完全反应的实验数据,由放出二氧化碳的质量计算反应消耗盐酸的质量;
由于前4次实验数据间的差值都可知,前四次实验放出二氧化碳的质量均为1.1g,说明前四次实验中所加稀盐酸都完全反应,因此在计算盐酸质量时,可使用前四次的数据进行计算.
解答:解:(1)甲组:设12g样品中碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x10g
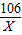 =
=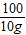
x═10.6g
样品中Na2CO3%=
 =100%=88.3%;
=100%=88.3%;乙组:由表中数据可知,从第6次加入稀盐酸后质量不在减少,说明第5次碳酸钠已完全反应.
第2次加入盐酸20g后,溶液增重的质量为(97.8g-78.9g)=18.9g,则减少的质量为生成二氧化碳的质量,由此可得加入20克稀盐酸可以生成二氧化碳的质量为20g-(97.8g-78.9g)=1.1g;
第5次加入盐酸后生成二氧化碳的质量为:20g-(155.05g-135.60g)=0.55g;
则加入5次盐酸后生成二氧化碳的总质量为:1.1g+1.1g+1.1g+1.1g+0.55g=4.95g
设13.5g样品中碳酸钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
y 4.95g
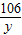 =
=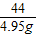 y=11.925g
y=11.925g样品中Na2CO3%=
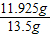 =88.3%;
=88.3%;(2)生成二氧化碳的质量为:20g-(97.8g-78.9g)=1.1g
设20g盐酸中氯化氢的质量是z
Na2CO3+2HCl═2NaCl+CO2↑+H2O
73 44
z 1.1g
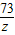 =
=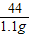 z═1.825g
z═1.825g该稀盐酸中溶质的质量分数=
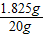 ×100%=9.1%;
×100%=9.1%;答:(1)甲组和乙组同学的实验结果,样品中碳酸钠的质量分数均为88.3%;
(2)乙组实验时所用稀盐酸中溶质的质量分数为9.1%.
点评:使用第2次实验数据计算时,产生二氧化碳的质量1.1g×2=2.2g,稀盐酸的质量20g×2=40g,第3、4次实验依此类推.

练习册系列答案
相关题目
(2008?丰台区二模)某化学小组同学用一氧化碳还原氧化铁后的剩余固体做探究实验,过程如下:
(提出问题)该固体的成分是什么?
(查阅资料)①铁和硫酸铁反应的化学方程式是:Fe+Fe2(SO4)3═3FeSO4
②Fe2(SO4)3溶液为黄色,FeSO4溶液为浅绿色.
(作出猜想)该固体中含有铁粉和氧化铁
同学们猜想该固体含有氧化铁的依据是______.
(设计实验)
(同学们想计算)2g样品中氧化铁的质量分数,请你帮助他们想一想用“固体减重”还是用“石灰水增重”计算更为准确?______.理由是______.
(提出问题)该固体的成分是什么?
(查阅资料)①铁和硫酸铁反应的化学方程式是:Fe+Fe2(SO4)3═3FeSO4
②Fe2(SO4)3溶液为黄色,FeSO4溶液为浅绿色.
(作出猜想)该固体中含有铁粉和氧化铁
同学们猜想该固体含有氧化铁的依据是______.
(设计实验)
| 实验操作 | 实验现象 | 结论及相关化学方程式 | |
| 验证猜想 | 实验①取2g样品,放入玻璃管中,如图连接仪器,进行实验. 实验完毕,再称固体质量 | 现象一:____________ . 现象二: 反应后固体质量为1.88g,澄清石灰水增重0.3g | |
| 实验②另取2g样品放入试管中,加入少量稀硫酸. | 现象一:____________ ; 现象二: 生成浅绿色溶液. | ||
| 综合分析实验①、②现象,得出结论:猜想正确 | |||





