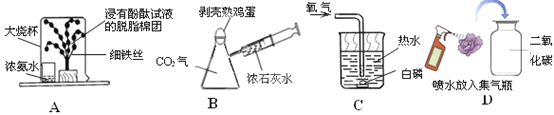
题目内容
【题目】A、B、C、D、E、F、G七种物质有如下图所示的相互转化关系:
已知:常温下,单质甲、化合物乙均为黑色固体,而F则为红色的固体单质。A、C、D、E、G均为无色气体,且气体A中只含有两种元素,它们质量比为3:1。请回答下列问题:
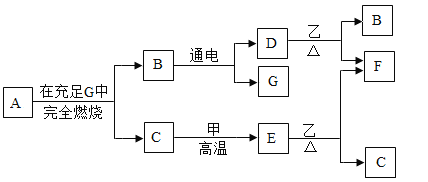
(1)写出D与乙反应的化学方程式_____;
(2)写出A在充足G中完全燃烧的化学方程式:_____;
(3)写出B通电发生的化学方程式_____;
(4)写出C和甲在高温条件下反应的方程式_____。
【答案】H2+CuO![]() Cu+H2O CH4+2O2
Cu+H2O CH4+2O2![]() CO2+2H2O 2H2O
CO2+2H2O 2H2O![]() 2H2↑+O2↑ C+CO2
2H2↑+O2↑ C+CO2![]() 2CO
2CO
【解析】
A、B、C、D、E、F、G七种物质,常温下,单质甲、化合物乙均为黑色固体,而F则为红色的固体单质,所以F是铜,B通电会生成D和G,所以B是水,A、C、D、E、G均为无色气体,且气体A中只含有两种元素,它们质量比为3:1,所以A是甲烷,甲烷和氧气在点燃的条件下生成水和二氧化碳,所以G是氧气,C是二氧化碳,二氧化碳和碳在高温的条件下生成一氧化碳,所以甲是碳,E是一氧化碳,一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,所以乙是氧化铜,D和氧化铜加热生成铜和水,所以D氢气,经过验证,推导正确。
(1)氢气和氧化铜在加热的条件下,生成铜和水,故答案为:H2+CuO![]() Cu+H2O;
Cu+H2O;
(2)甲烷和氧气在点燃的条件下生成二氧化碳和水,配平即可.故答案为:CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(3)水在通电的条件下生成氢气和氧气,配平即可.故答案为:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(4)二氧化碳和碳在高温条件下反应生成一氧化碳,故答案为:C+CO2![]() 2CO。
2CO。

【题目】化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取用20g石灰石样品,进行高温煅烧(样品中除碳酸钙外,其余成分高温不分解。碳酸钙分解的化学方程式为CaCO3 == CaO + CO2↑),不同时间测得剩余固体的质量如下表所示:
煅烧的时间(min) | 剩余固体的质量(g) |
2 | 17.8 |
4 | 13.4 |
6 | 12.3 |
8 | 12.3 |
(1)完全反应后生成二氧化碳的质量_____________。
(2)求石灰石样品中碳酸钙的质量分数_______
【题目】化学兴趣小组为验证质量守恒定律,按照如图装置进行实验,称取24g镁粉在空气中燃烧,发现产物中有少量黄色固体。
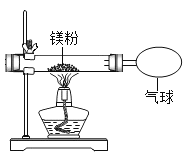
(提出问题)黄色固体是什么呢?
(查阅资料)
①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生
氨气,该气体能使湿润的红色石蕊试纸变蓝
(做出猜想)黄色固体是Mg3N2.
(实验探究)请设计实验,验证猜想。
实验操作 | 实验现象及结论 |
取燃烧后的产物于试管中,加少量_____,再将_____放在试管口,观察观象。 | 观察到_____,说明燃烧产物中含有Mg3N2。 |
(反思与交流)(1)Mg3N2中氮元素的化合价为_____。
(2)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的 MgO却远多于Mg3N2,其原因是_____。
(3)写出镁条在氮气中燃烧的化学方程式:_____。