题目内容
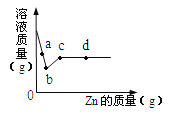
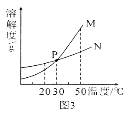
【题目】甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
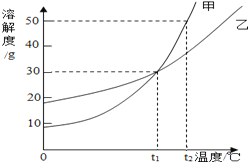
A. t1℃时,甲和乙的溶解度均为30
B. t2℃时,甲和乙的饱和溶液中溶质的质量分数相等
C. t2℃时,在100g水中放入60g甲,其溶质的质量分数为37.5%
D. t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
【答案】D
【解析】试题分析:A、t1℃时,甲和乙的溶解度曲线相交,根据此特征比较两物质的溶解度;
B、根据t2℃时,甲和乙的溶解度大小,比较t2℃时,甲和乙的饱和溶液中溶质的质量分数;
C、根据t2℃时,甲物质的溶解度判断此温度下100g水中放入60g甲物质的溶解情况;
D、综合溶解度变化趋势和t2℃时两物质的溶解度,判断降温对两物质溶液准状态的影响.
解:A、t1℃时,甲和乙的溶解度曲线相交于溶解度为30g的一点,说明此时它们的溶解度均为30g.题中因没指明溶解度的单位造成叙述不正确;
B、饱和溶液的溶质质量分数可由该温度下的溶解度S求得,溶质质量分数=![]() ×100%.t2℃时甲乙两种物质的溶解度关系为S甲>S乙,所以t2℃时甲和乙的饱和溶液中溶质的质量分数相等的说法是不正确;
×100%.t2℃时甲乙两种物质的溶解度关系为S甲>S乙,所以t2℃时甲和乙的饱和溶液中溶质的质量分数相等的说法是不正确;
C、t2℃时甲物质的溶解度为50g,在100g水中放入60g甲在t2℃时不能全部溶解,得到饱和溶液,其溶质质量分数可利用t2℃时的溶解度50g求得,溶质质量分数=![]() ×100%≈33.3%.题中的37.5%不正确;
×100%≈33.3%.题中的37.5%不正确;
D、若在100g水中各溶解20g达饱和,说明此时物质的溶解度恰好为20g,根据曲线,从t2℃为起点开始降温,甲物质首先降至溶解度为20g时的温度.所以说甲物质先饱和是正确的.
故选D.

练习册系列答案
相关题目