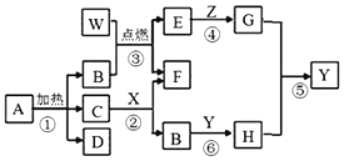
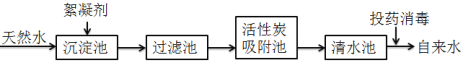
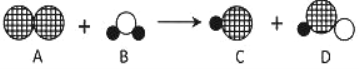
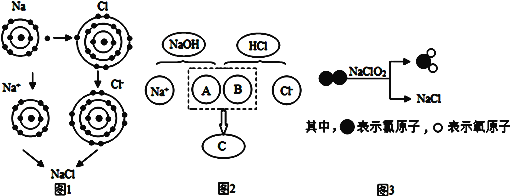
题目内容
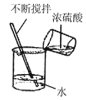
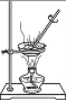
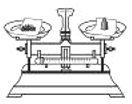
【题目】某同学配制 50 g 9%的氯化钠溶液,整个操作过程如图所示,回答下列问题:

(1)配制溶液的正确操作顺序为__________(填序号,后同),其中操作错误的是__________。
(2)该实验中所需食盐的质量是______________________。
(3)量水时选用的量筒的量程最合适的是____________(填字母),读数时视线要与量筒内_________________保持水平。
A 10 mL B 25 mL C 50 mL D 100 mL
【答案】②①⑤③④ ① 4.5g C 液体凹液面最低处
【解析】
(1)配制50g 9%氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,配制溶液的正确操作顺序为②①⑤③④;托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,所以其中操作错误的是①
(2)溶质质量=溶液质量×溶质的质量分数,配制50g9%氯化钠溶液,需氯化钠的质量=50g×9%=4.5g;
(3)溶剂质量=溶液质量-溶质质量,所需溶剂的质量为50g-4.5g=45.5g(合45.5mL),应用规格为50mL的量筒量取水的体积。故选C;读数时视线要与量筒内液体凹液面最低处保持水平。

【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请你计算:
(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 1.00 | 6.00 |
(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。_____(请你注明具体的坐标)