题目内容
根据氧化铁化学式(Fe2O3)计算(1)铁元素的质量分数?
(2)160t氧化铁含铁多少t?
【答案】分析:(1)根据化合物中元素的质量分数= ×100%,进行分析解答.
×100%,进行分析解答.
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答:解:(1)氧化铁中铁元素的质量分数为 100%=70%.
100%=70%.
(2)160t氧化铁含铁的质量为:160t×70%=112t.
故答案为:(1)70%;(2)112t.
点评:本题难度不大,考查灵活运用化学式的有关计算进行分析问题、解决问题的能力.
 ×100%,进行分析解答.
×100%,进行分析解答.(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答:解:(1)氧化铁中铁元素的质量分数为
 100%=70%.
100%=70%.(2)160t氧化铁含铁的质量为:160t×70%=112t.
故答案为:(1)70%;(2)112t.
点评:本题难度不大,考查灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 在如图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质.A是金属单质,C为红棕色固体粉末,B、D、K常温下都为气体,E、H都属于盐,F为能溶于水的碱.框图中有关反应的部分生成物没有标出.请根据框图中物质的转化关系填写下列空白:
在如图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质.A是金属单质,C为红棕色固体粉末,B、D、K常温下都为气体,E、H都属于盐,F为能溶于水的碱.框图中有关反应的部分生成物没有标出.请根据框图中物质的转化关系填写下列空白:
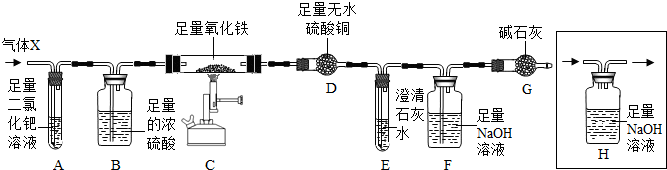
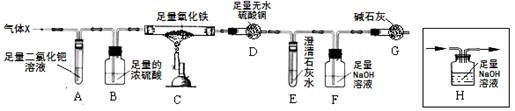
 8Fe
+nCO2+2nH2O,其中n的值为
(填数字)。
8Fe
+nCO2+2nH2O,其中n的值为
(填数字)。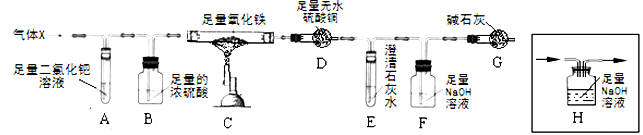
 8Fe +nCO2+2nH2O,其中n的值为____________(填数字)。
8Fe +nCO2+2nH2O,其中n的值为____________(填数字)。