题目内容
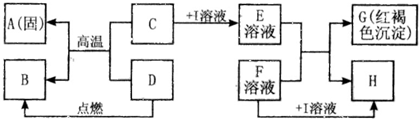
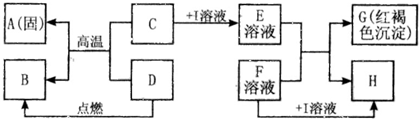
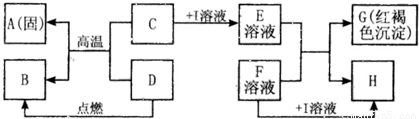
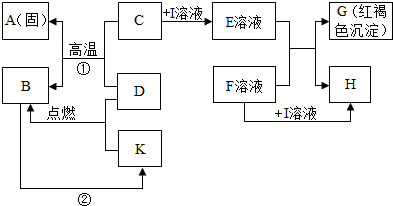 在如图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质.A是金属单质,C为红棕色固体粉末,B、D、K常温下都为气体,E、H都属于盐,F为能溶于水的碱.框图中有关反应的部分生成物没有标出.请根据框图中物质的转化关系填写下列空白:
在如图所示的有关物质转化关系中,各物质均是我们初中化学所学的物质.A是金属单质,C为红棕色固体粉末,B、D、K常温下都为气体,E、H都属于盐,F为能溶于水的碱.框图中有关反应的部分生成物没有标出.请根据框图中物质的转化关系填写下列空白:(1)C是
氧化铁
氧化铁
,G是氢氧化铁
氢氧化铁
.(2)反应①方程式是
Fe203+3CO
2Fe+3CO2
| ||
Fe203+3CO
2Fe+3CO2
;反应②方程式是
| ||
6CO2+6H2O
C6H12O6+6O2
| ||
6CO2+6H2O
C6H12O6+6O2
| ||
(3)F→H的基本反应类型是
复分解反应
复分解反应
反应,若H为难溶性的盐,则I的化学式为H2SO4
H2SO4
.分析:由于G是红褐色沉淀,所以G是氢氧化铁,因为F是可溶性碱,所以E溶液是铁离子溶液,由于C是一种固体粉末,所以C是三价铁的氧化物,I溶液属于一种酸溶液,再根据图示中反应进行进一步分析即可.
解答:解:学过去的红褐色沉淀只有氢氧化铁沉淀,由G是红褐色沉淀,所以G是氢氧化铁,F是可溶性碱,所以E溶液是铁离子溶液,又因为E和F生成G和H,H是难溶性的盐,如果E是氯化铁时,碱溶液中必须含有银离子才行,氢氧化银是不存在的,所以E不能是氯化铁,如果是硝酸铁时不能产生硝酸盐沉淀,所以E是硫酸铁溶液,F是氢氧化钡溶液,因为C是一种固体粉末,与D反应高温生成A金属单质和B,所以A是铁,C是氧化铁,I溶液只能是硫酸了,D能与氧化铁反应生成铁,说明D是具有还原性的,具有还原性的物质有:氢气、一氧化碳、碳,又因为D是一种气体,所以D可以是氢气,也可以是一氧化碳,如果D是氢气时,B就是水,如果D是一氧化碳时,B就是二氧化碳.B可以由一氧化碳和K燃烧得到,所以K是氧气;
(1)分析知C与G分别是氧化铁和氢氧化铁;
(2)反应①方程式是Fe203+3CO
2Fe+3CO2;反应②方程式是二氧化碳转化为氧气的过程是光合作用的体现,方程式为6CO2+6H2O
C6H12O6+6O2;
(3)F→H的反应是氢氧化钡和硫酸反应生成硫酸钡和水,属于复分解反应.
故答案为:(1)氧化铁;氢氧化铁;(2)Fe203+3CO
2Fe+3CO2;6CO2+6H2O
C6H12O6+6O2;(3)分解反应;H2SO4.
(1)分析知C与G分别是氧化铁和氢氧化铁;
(2)反应①方程式是Fe203+3CO
| ||
| ||
(3)F→H的反应是氢氧化钡和硫酸反应生成硫酸钡和水,属于复分解反应.
故答案为:(1)氧化铁;氢氧化铁;(2)Fe203+3CO
| ||
| ||
点评:解答本题的关键是红褐色沉淀,属于氢氧化铁,再从后面往前面推,要知道三大还原剂有氢气、一氧化碳、碳,再结合所给信息,进行进一步推断.

练习册系列答案
相关题目