题目内容
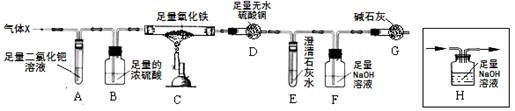
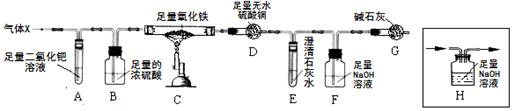
(7分)X混合气体由H2、CO、CH4的成分组成,为检验气体的成分设计了如下的实验装置(注:夹持装置未画出;无水硫酸铜遇水由白色变成蓝色,可用于检验水的存在):
【查阅资料】
(1)CO和二氯化钯(PdCl2)溶液反应产生黑色钯(Pd):CO+PdCl2+H2O=CO2+Pd↓+2X,该反应中X的化学式是 。
(2)在高温条件下,H2可还原氧化铁,产生铁和水。在高温条件下,CH4也可与Fe2O3反应:4Fe2O3+nCH4
 8Fe
+nCO2+2nH2O,其中n的值为
(填数字)。
8Fe
+nCO2+2nH2O,其中n的值为
(填数字)。
【提出假设】关于X混合气体的组成,同学们提出下列假设:
①H2和CO ②H2和CH4 ③CO和CH4 ④H2、CO和CH4
【实验现象】A中出现黑色固体;C中固体逐渐变为黑色;D固体变为蓝色;E中溶液变浑浊。
【问题讨论】
(3)根据以上实验现象,甲同学和老师一致认为:可排除假设 (填假设序号)。
(4)根据以上实验现象,乙认为可排除“假设①”。你认为乙的结论是否正确? 。
(5)丙同学认为:要验证剩余的假设是否成立,需要在A、B之间增加装置H,但该装置未画完整,请在答题卡中将装置画完整。
(6)丁同学利用改进后的装置进行实验,测得实验中装置D质量增加m1g,装置E和F质量增加的总和为m2g,若m1∶m2= (填写比值),则“假设③”成立。
(1)HCl(1分) (2) 3 (1分)
(3)② (1分) (4)不正确(1分)
(5)②如右图 (长管不伸入液面下不给分,不作美观要求)(1分)
(长管不伸入液面下不给分,不作美观要求)(1分)
(6)9∶11(2分)
【解析】:(1)根据化学反应前后原子的种类和数目不变,由CO+PdCl2+H2O=CO2+Pd↓+2X可知,该反应中X的化学式是HCl;
(2)由质量守恒定律化学反应前后原子的种类和数目不变可知,4Fe2O3+nCH4 8Fe+nCO2+2nH2O,n的值为3;
8Fe+nCO2+2nH2O,n的值为3;
(3)A中出现黑色固体说明有一氧化碳,所以排除假设②;
(4)如果只有氢气和一氧化碳气体也出现以上现象,所以乙的结论不正确;
(5)气体的流向可知,要验证剩余的假设是否成立,需要在A、B之间增加装置H,则H装置如图: ;
;
(6)由4Fe2O3+3CH4  8Fe+3CO2+6H2O可知,生成水和二氧化碳质量比=(6×18):(3×44)=9:11,所以m1:m2=9:11时,“假设③”成立.
8Fe+3CO2+6H2O可知,生成水和二氧化碳质量比=(6×18):(3×44)=9:11,所以m1:m2=9:11时,“假设③”成立.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案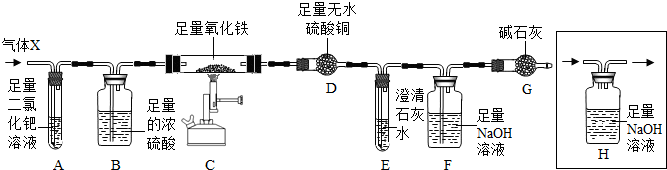
 8Fe +nCO2+2nH2O,其中n的值为 (填数字)。
8Fe +nCO2+2nH2O,其中n的值为 (填数字)。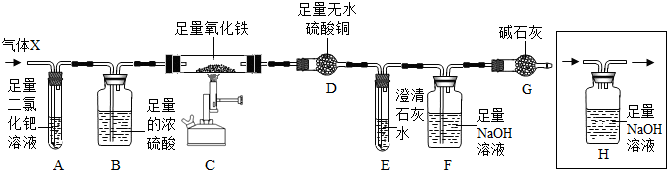
 8Fe+nCO2+2nH2O,其中n的值为______(填数字).
8Fe+nCO2+2nH2O,其中n的值为______(填数字).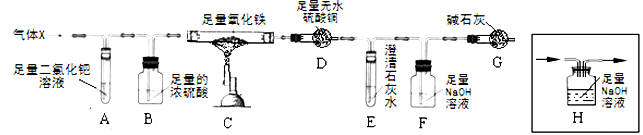
 8Fe +nCO2+2nH2O,其中n的值为____________(填数字)。
8Fe +nCO2+2nH2O,其中n的值为____________(填数字)。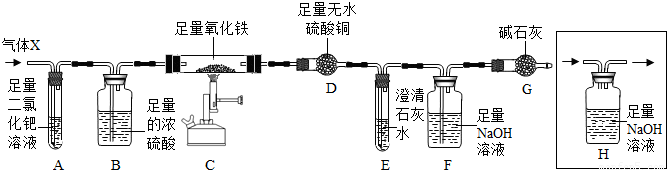
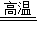 8Fe+nCO2+2nH2O,其中n的值为______(填数字).
8Fe+nCO2+2nH2O,其中n的值为______(填数字).