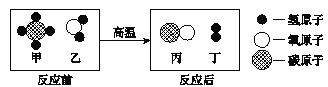
题目内容
【题目】结合如图所示实验装置,回答下列问题。
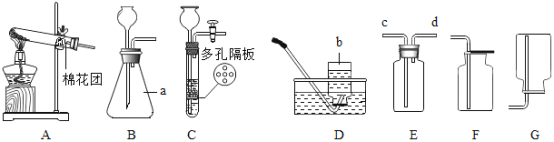
(1)请写出仪器的名称:a_______ b________
(2)用B、D装置制取并收集氧气,反应方程式为_____;装置E收集氧气时,当观察到______时说明已经收满氧气;
(3)若要收集一瓶氧气,供“铁丝在氧气中燃烧”实验使用,最好用D装置收集。 理由是_____、_______(写出2点)。
(4)实验室用装置C制取二氧化碳,与装置B相比,其优点为______,如用E装置收集二氧化碳,气体由导管______(填c或d)通入。
【答案】锥形瓶 集气瓶 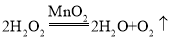 d导管口处带火星木条复燃 收集的氧气比较纯净 可以在集气瓶内留部分水 可控制反应的发生与停止 c
d导管口处带火星木条复燃 收集的氧气比较纯净 可以在集气瓶内留部分水 可控制反应的发生与停止 c
【解析】
(1)a是锥形瓶,b是集气瓶。
(2)B装置是固液常温型装置,用B、D装置制取并收集氧气,则是用过氧化氢溶液制取氧气,反应的方程式为: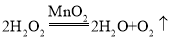 ;装置E收集氧气时,由于氧气的密度比空气的密度大,氧气由导气管的c端进入,空气由d端排出,当观察到d导管口处带火星木条复燃时说明已经收集满氧气;
;装置E收集氧气时,由于氧气的密度比空气的密度大,氧气由导气管的c端进入,空气由d端排出,当观察到d导管口处带火星木条复燃时说明已经收集满氧气;
(3)若要收集一瓶氧气,供“铁丝在氧气中燃烧”实验使用,最好用排水法收集,原因是用排水法收集的氧气比较纯净。另外铁丝燃烧放出大量的热,能使固体熔化为液体落到瓶底而炸裂集气瓶底部,用排水法收集氧气时,可以在集气瓶内留部分水,防止瓶底炸裂。
(4)实验室用装置C制取二氧化碳,关闭装置C中的活塞,二氧化碳气体不能排出,试管内压强变大,稀盐酸被压进长颈漏斗中与大理石脱离,反应停止,打开活塞,二氧化碳气体排出,试管内压强变小,稀盐酸进入试管内与大理石接触,反应发生,与装置B相比,装置C的优点为可控制反应的发生与停止。由于二氧化碳的密度比空气的密度大,进入E装置以后占据下方空间,空气则被赶到上方空间而易从d端排出,故如果用E装置收集二氧化碳,气体由导管c通入。

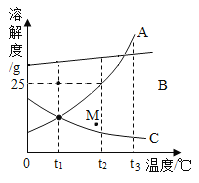
【题目】下图是A、B、C三种固体物质的溶解度曲线图示,请根据溶解度曲线图示按要求回答下列问题:
①在t1°C时, 三种物质中溶解能力最强的物质是__________________。 |
|
②若A中含少量的B,提纯A的方法是__________________。 | |
③将t3°C等质量的A、B、C三种物质的饱和溶液降温到t1°C,从溶液里析出较多溶质的是__________________。 | |
④t2°C时,将50克A加入100克水,充分溶解后所得溶液中溶质的质量分数是____________。 |
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
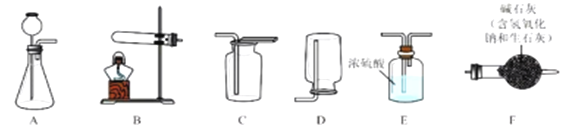
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。