题目内容
【题目】回答下列问题:
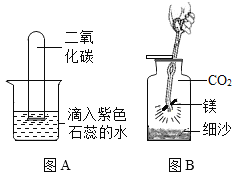
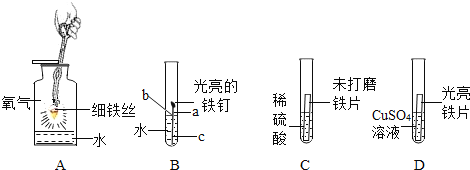
(1)如图A所示,将充满CO2的试管倒扣在滴有石蕊溶液的蒸馏水中,观察一段时间,请将观察到的现象,以及对该现象的解释填入下表:
实验现象 | 解释 |
①_____ | _____ |
②_____ | _____ |
(2)如图B所示,将镁条点燃后迅速伸入盛满CO2的集气瓶中,镁条在CO2中剧烈燃烧反应的化学方程式为:2Mg+CO2![]() 2MgO+C,请推测镁条在CO2中燃烧的现象:剧烈燃烧,________________________________ 。
2MgO+C,请推测镁条在CO2中燃烧的现象:剧烈燃烧,________________________________ 。
【答案】试管内液面上升 二氧化碳溶于水,导致试管内压强减小,大气压将水压进试管中 试管内溶液变红 二氧化碳与水反应生成碳酸,碳酸使石蕊变红 产生白光,生成黑色固体和白色固体
【解析】
(1)①首先观察到的现象是试管内液面上升,形成一段液柱,故填试管内液面上升;
管内液面上升的原因是二氧化碳溶于水,导致试管内压强减小,大气压将水压进试管中,故填二氧化碳溶于水,导致试管内压强减小,大气压将水压进试管中。
②还会观察到试管内溶液变红,故填试管内溶液变红;
试管内溶液变红是因为二氧化碳与水反应生成碳酸,碳酸使石蕊变红,故填二氧化碳与水反应生成碳酸,碳酸使石蕊变红。
(2)由化学方程式可知,镁与二氧化碳在点燃的条件下反应生成氧化镁和碳粉,所以观察到的现象是产生白光,生成黑色固体和白色固体,故填产生白光,生成黑色固体和白色固体。

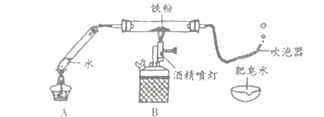
【题目】某小组同学在用过氧化氢溶液与![]() 制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。对此,它们进行了如下探究:
制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。对此,它们进行了如下探究:
(猜想与假设)
①速率慢、气泡少可能与过氧化氢溶液的浓度有关。
②速率慢、气泡少可能与![]() 的质量有关。
的质量有关。
(进行实验)
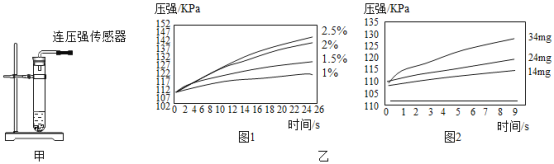
根据图甲进行如下实验。
实验1:用26mg![]() 与5mL不同浓度过氧化氢溶液进行实验,压强变化如乙图1。
与5mL不同浓度过氧化氢溶液进行实验,压强变化如乙图1。
实验2:用5mL 1.5%过氧化氢溶液与不同质量![]() 进行实验,压强变化如乙图2。
进行实验,压强变化如乙图2。
(解释与结论)
(1)实验1得到的结论是______,实验2的目的是______。欲得出“![]() 能加快过氧化氢的分解”这一结论,需要对比______。(简要的写出实验设想)
能加快过氧化氢的分解”这一结论,需要对比______。(简要的写出实验设想)
(2)小组同学查阅资料得知:多种物质能催化过氧化氢的分解。
(实验探究)
实验证明,![]() 溶液也能显著加快过氧化氢的分解,
溶液也能显著加快过氧化氢的分解,![]() 溶液主要含有三种粒子(
溶液主要含有三种粒子(![]() ),稀硫酸中含有三种粒子(
),稀硫酸中含有三种粒子(![]() )为了进一步探究
)为了进一步探究![]() 溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计:
溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计:
①小组同学认为最不可能的是![]() ,他们的理由是______。
,他们的理由是______。
②要说明另外的两种粒子是否起到催化作用,小组同学设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL 5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液中几乎没有气泡放出 | 验证明,起催化作用的是______。 |
b.另取一支试管加入5mL 5%过氧化氢溶液,然后加入2-3滴硫酸铜溶液 | 溶液中有大量气泡放出 |
(3)(反思与评价)
小组同学在进行实验1和2制取氧气过程中,发现反应的速度很慢,产生的气泡很少的原因可能是______、______。
(4)利用图甲装置不能探究“温度对过氧化氢分解速率”的影响,其理由是______。