题目内容
在托盘天平两边各放一只烧杯并注入相同质量、相同溶质质量分数的稀盐酸,调节至平衡,然后向左、右两边烧杯中分别投入等质量的镁和铝,待完全反应后,镁有剩余,则还可观察的的现象是
- A.铝也有剩余
- B.先偏向右,最后平衡
- C.先偏向右,最后偏向左
- D.先偏向左,最后平衡
AB
试题分析:根据金属活动性顺序可知,镁的活动性比铝强,故镁比铝与稀盐酸反应的速率快,即短时间内产生的氢气多,则放镁的一边质量减轻的多,故天平会先偏向铝的一边(右);
根据题意,镁、铝与稀盐酸的反应如下:
Mg+2HCl=MgCl2+H2↑ 2Al+6HCl=2AlCl3+3H2↑
24 73 2 54 219 6
根据以上反应中物质的质量比可知,等质量的酸与铝、镁完全反应时,铝消耗的质量少,镁消耗的质量多;而题目中“相同质量、相同溶质质量分数的稀盐酸中分别投入等质量的镁和铝,待完全反应后,镁有剩余”,可知铝也应有剩余(且剩余的比镁多),故酸一定完全反应,由于酸的质量相等,而氢气来源于酸,所以生成的氢气质量一定相等,从而可判断天平仍保持平衡。故选AB
考点:金属的化学性质,酸的化学性质,质量守恒定律及其应用,根据化学反应方程式的计算
点评:这是一道天平平衡问题,解题的关键是,能够分析出反应过程中生成氢气量的多少,天平总偏向生成氢气少的一边。
试题分析:根据金属活动性顺序可知,镁的活动性比铝强,故镁比铝与稀盐酸反应的速率快,即短时间内产生的氢气多,则放镁的一边质量减轻的多,故天平会先偏向铝的一边(右);
根据题意,镁、铝与稀盐酸的反应如下:
Mg+2HCl=MgCl2+H2↑ 2Al+6HCl=2AlCl3+3H2↑
24 73 2 54 219 6
根据以上反应中物质的质量比可知,等质量的酸与铝、镁完全反应时,铝消耗的质量少,镁消耗的质量多;而题目中“相同质量、相同溶质质量分数的稀盐酸中分别投入等质量的镁和铝,待完全反应后,镁有剩余”,可知铝也应有剩余(且剩余的比镁多),故酸一定完全反应,由于酸的质量相等,而氢气来源于酸,所以生成的氢气质量一定相等,从而可判断天平仍保持平衡。故选AB
考点:金属的化学性质,酸的化学性质,质量守恒定律及其应用,根据化学反应方程式的计算
点评:这是一道天平平衡问题,解题的关键是,能够分析出反应过程中生成氢气量的多少,天平总偏向生成氢气少的一边。

练习册系列答案
相关题目
在托盘天平两边各放一只烧杯,调节至平衡.在两烧杯中分别注入等质量等浓度且足量的稀硫酸,在左烧杯中投入少量的锌粒,在右烧杯中投入相同质量的镁条,锌粒和镁条完全溶解后,天平的指针( )
| A、偏左 | B、偏右 | C、指向中间 | D、无法判断 |
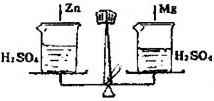
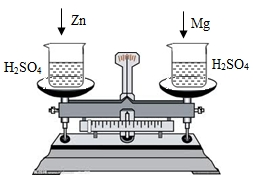 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )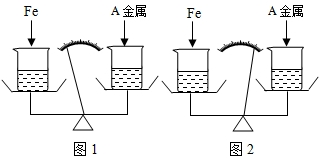 在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )
在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )