题目内容
在托盘天平两边各放一只烧杯,调节至平衡.在两烧杯中分别注入等质量等浓度且足量的稀硫酸,在左烧杯中投入少量的锌粒,在右烧杯中投入相同质量的镁条,锌粒和镁条完全溶解后,天平的指针( )
| A、偏左 | B、偏右 | C、指向中间 | D、无法判断 |
分析:天平原来是平衡的,反应后天平是否平衡,主要看反应后两个托盘中剩余物的质量是否相等.本题的反应物的质量相等,则放出氢气的质量越大,剩余物的质量就越小.本题可以假设锌粒和镁条的质量都是M克,然后写出化学方程式计算出氢气的质量.
解答:解:假设锌粒和镁条的质量都是M克,设锌和硫酸生成氢气的质量是X,镁和硫酸反应生成氢气的质量是Y.
Mg+H2SO4═MgSO4+H2↑
24 2
M克 X
═
得:X=
克
Zn+H2SO4═ZnSO4+H2↑
65 2
M克 Y
═
得:Y=
克
∴镁条和稀硫酸生成的氢气的质量大于锌和硫酸生成的氢气的质量,因此,右盘中剩余物的质量小于左盘中剩余物的质量.
∴指针向左偏转,故选A.
Mg+H2SO4═MgSO4+H2↑
24 2
M克 X
| 24 |
| 2 |
| M克 |
| X |
得:X=
| M |
| 12 |
Zn+H2SO4═ZnSO4+H2↑
65 2
M克 Y
| 65 |
| 2 |
| M克 |
| Y |
得:Y=
| 2M |
| 65 |
∴镁条和稀硫酸生成的氢气的质量大于锌和硫酸生成的氢气的质量,因此,右盘中剩余物的质量小于左盘中剩余物的质量.
∴指针向左偏转,故选A.
点评:掌握化学方程式的计算格式和规范性,记住:天平是否平衡一般看两个托盘中物质的质量,哪个托盘中物质的质量大,指针就向哪个方向偏转.

练习册系列答案
相关题目

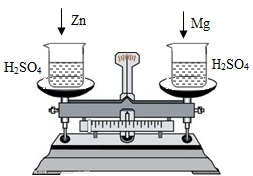 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( ) 在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )
在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )