题目内容
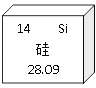
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为![]() ,还含有硅、铝等杂质。制备流程如图所示:
,还含有硅、铝等杂质。制备流程如图所示:
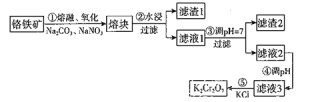
请回答下列问题:
步骤①的主要反应为:
![]()
(1)铬铁矿熔融氧化前要粉碎的目的是_______________________。
(2)滤渣1中含量最高的金属元素是_______,滤渣2的主要成分是氢氧化铝和含硅杂质。
(3)步骤④调节滤液2的PH使之变小,可以提高滤液中![]() 的浓度。
的浓度。
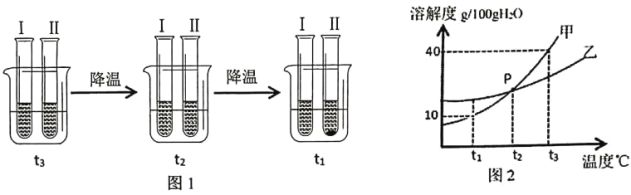
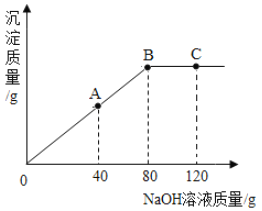
(4)有关物质的溶解度如下图所示。向“滤液3”中加入适量![]() ,蒸发浓缩、________、过滤得到
,蒸发浓缩、________、过滤得到![]() 固体。在温度为_________(填字母)时,得到的
固体。在温度为_________(填字母)时,得到的![]() 固体产品最多。
固体产品最多。
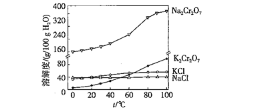
A 80℃ B 60℃ C 40℃ D 10℃
(5)步骤⑤主要反应的化学方程式________。
【答案】增大反应物的接触面积,加快反应速率 Fe 降温结晶 d Na2CrO4+2KCl=K2CrO4+2NaCl
【解析】
(1)铬铁矿熔融氧化前要粉碎的目的是:增大反应物的接触面积,加快反应速率;
(2)滤渣1中主要含有氧化亚铁被氧化而得到氧化铁,所以滤渣1中含量最高的金属元素是Fe,滤渣2的主要成分是氢氧化铝和含硅杂质;
(4)重铬酸钾的溶解度受温度的变化影响较大,所以向“滤液3”中加入适量KCl,蒸发浓缩、降温结晶、过滤得到K2Cr2O7固体。在温度为10℃时,得到的K2Cr2O7固体产品最多,故选:d;
(5)步骤⑤的反应是重铬酸钠和氯化钾反应生成重铬酸钾和氯化钠,化学方程式为:Na2CrO4+2KCl=K2CrO4+2NaCl。

【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
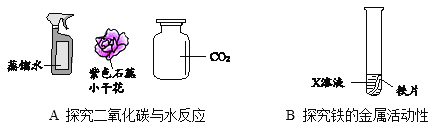
A | B |
(1)图A探究二氧化碳与水反应的实验操作为_____。 (2)该实验的结论是_____(可用化学方程式表示)。 | (1)图B中,若X溶液为硫酸铜溶液,则反应的化学方程为_____。 (2)若X溶液为稀盐酸,观察到有气泡产生,该反应发生的原因是_____。 |