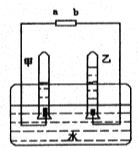
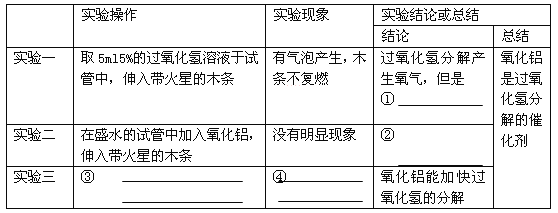
题目内容
【题目】(7分)某混合溶液中含有氯化铜和稀盐酸,向其中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示:

(1)当加入的氢氧化钠溶液为20g时,所得溶液的溶质是____________________;
(2)反应最终生成的沉淀质量为__________;
(3)当加入氢氧化钠溶液为60g时,溶液中溶质的质量是多少?(写出具体计算步骤)
【答案】(1)CuCl2和NaCl;(2)9.8g;(3)17.55g
【解析】
试题分析:加入HCl后首先发生反应:NaOH+HCl=NaCl+H2O。m(NaOH)=20g×20%=4g,所以溶液中含有的HCl的质量是3.65g;产生的NaCl质量是5.85g ;(1)当加入的氢氧化钠溶液为20g时,恰好完全发生上述反应,因此所得溶液的溶质是NaCl和CuCl2。(2)后来加入NaOH,发生反应:CuCl2+2NaOH=Cu(OH)2↓+2NaCl. m(NaOH)=40g×20%=8g,故根据方程式中各种物质之间的质量关系可得:溶液中含有CuCl2的质量是13. 5g,产生NaCl的质量是11.7g;产生的氢氧化铜的质量是9.8g。(3)当加入氢氧化钠溶液为60g时,HCl和CuCl2都恰好完全反应,此时的溶液为NaCl溶液,其质量是5.85g+11.7g=17. 55g。

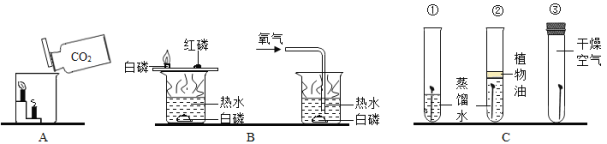
【题目】合理运用燃烧与灭火的化学原理对保障生命财产安全非常重要。
(1)2013年12月广州建业大厦发生严重火灾。从燃烧条件分析,大厦内存放的大量鞋、纸箱等物品充当了________________。
(2)高层建筑物通常设计了灭火用的洒水系统。从灭火原理分析,洒水的作用主要是______________。
(3)分析下表中的数据,回答问题:
物质代号 | L | M | N | P |
熔点/℃ | -117 | 3550 | 44 | -259 |
沸点/℃ | 78 | 4827 | 257 | -253 |
着火点/℃ | 510 | 370 | 40 | 580 |
①有人认为“物质的熔、沸点越高,着火点越高”,该结论_______________(填“合理”或“不合理”)。
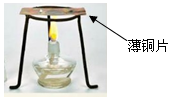
②已知酒精灯火焰的温度约为500℃。利用上图装置,验证达到可燃物着火点是燃烧的条件之一,上表中可用于完成该实验的两种可燃物是_________和________(填代号)。