题目内容
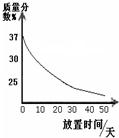
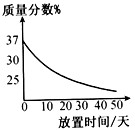
(1)实验室中有一瓶敞口放置的浓盐酸。它的质量分数和放置天数的关系如图1。假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因 。
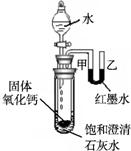
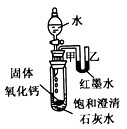
(2)观察图2,向小试管内滴加水后,可观察到的现象是 。解释产生此现象的原因 。
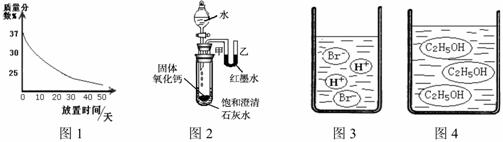 |
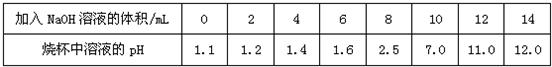
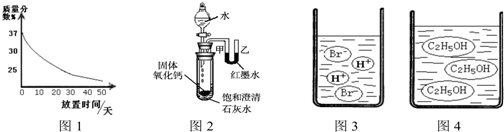
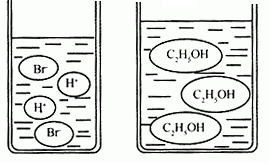
(3)图3图4分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图。请你结合已有的酸、碱知识,判断溴化氢的水溶液显 (填“酸性”、“中性”或“碱性”下同),乙醇的水溶液显 。
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下。请分析并回答下列问题:
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
①写出稀盐酸和氢氧化钠溶液反应的化学方程式 。
②若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显 色。
③若滴加的指示剂是无色酚酞溶液,加入氢氧化钠溶液充分振荡后,溶液颜色无变化。此时溶液中的溶质一定有(填化学式) 。
(1)浓盐酸具有挥发性,挥发出氯化氢气体
(2)石灰水变浑;U型管中甲端下降乙端上升。 氧化钙与水反应放热、氢氧化钙的溶解度随温度的升高而降低,有氢氧化钙从溶液中析出;氧化钙与水反应放热使试管内压强增大
(3)酸性、中性
(4)①HCl +NaOH ==== NaCl + H2O;②蓝 ③NaCl

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目