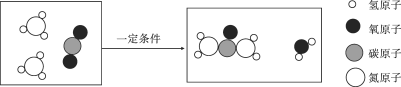
题目内容
【题目】农业的高产丰收离不开化肥的合理施用。如图标签为某品牌化肥的商标,为测定该化肥中(NH4)2SO4的含量,小红称取5.0g该化肥放入烧杯中,加水主要成分:(NH4)2SO4完全溶解,再将200gBa(OH)2溶液分4次加入其中(杂质溶于水但不参加反应)。测得数据如表所示:

次数 | 1 | 2 | 3 | 4 |
滴入Ba(OH)2溶液质量/g | 50 | 50 | 50 | 50 |
生成沉淀质量/g | 2.33 | 4.66 | m | 6.99 |
已知:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3↑+2H2O
(1)表中m的值为_____。
(2)计算Ba(OH)2溶液中溶质的质量分数并判断该化肥是否合格?(写出计算过程)。
(3)若用5.0g该化肥固体粉末与足量Ba(OH)2固体粉末充分研磨,请在如图中画出产生气体质量对应的变化图,并标注必要的数值。
【答案】(1)6.99;(2)不合格(详见解析);(3)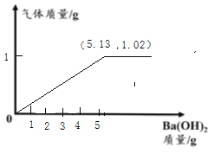
【解析】
(1)由图2中的图像信息可知,加入氢氧化钡的质量是150g时,是50g的3倍,所以生成沉淀的质量为:![]() ,当加入200g的氢氧化钡时,沉淀的质量不再增加,说明了硫酸铵已完全发生了反应;
,当加入200g的氢氧化钡时,沉淀的质量不再增加,说明了硫酸铵已完全发生了反应;
(2)设参加反应硫酸铵的质量为x,氢氧化钡的质量为y,生成的氨气的质量为z,
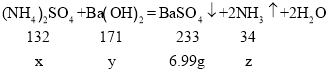
![]()
![]() ,
,
![]()
![]() ,
,
![]()
![]() ,
,
![]() 溶液中溶质的质量分数=
溶液中溶质的质量分数=![]() ;
;
硫酸铵的质量分数=![]() ,该化肥不合格;
,该化肥不合格;
(3)由上述计算和分析可画出加入的氢氧化钡与生成的氨气的质量关系图是: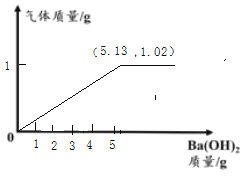 。
。

【题目】化学兴趣小组的同学欲用如图所示实验装置,通过实验探究质量守恒定律,根据实验目的,两位同学用了不同的药品进行实验,结果如下表所示:
所用药品 | 实验前后天平是否平衡 | |
小景 | 氯化钠溶液、硝酸钾溶液 | 平衡 |
小波 | 碳酸钙、稀盐酸 | 不平衡 |
(1)小景同学的天平一直平衡,他认为他的实验验证了质量守恒定律,但在小组讨论时,被同学指出设计错误,原因是_____。
(2)小波同学的实验中天平不平衡,你认为该反应是否_____(填“符合”、“不符合”之一)质量守恒定律,欲使反应前后天平平衡,可对该装置做的改进方法是_____
(3)化学反应前后,下列诸项中肯定没有变化的是_____(填A、B、C、D之一)
①原子的数目 ②分子的数目 ③元素的种类④原子的种类 ⑤物质的种类 ⑥分子的种类
A 只有①④⑥ B 只有①③④ C 只有①②④ D 只有②③⑥
(4)小玉同学做完了质量守恒定律的探究实验后,又欲测定一瓶标签破损的稀硫酸的溶质质量分数。她取了50g稀硫酸样品,逐滴加入10%的氢氧化钠溶液,用pH计测定溶液中pH变化如图所示,试回答:
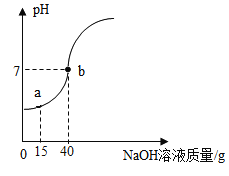
①当滴入氢氧化钠溶液15g时(即图中a点,烧杯内溶液中含有的溶质有_____、_____(写化学式)。
②计算所测稀硫酸的溶质质量分数_____(计算结果精确至0.1%)。
【题目】化学与人类生活息息相关。根据所学化学知识回答下列问题:
(1)如图是某校食堂周二午餐食谱的部分内容。
主食 | 米饭 |
副食 | 清蒸排骨、西红柿炒鸡蛋、咸味花生米 |
人体所需热量的60%~70%来自糖类,该食谱中富含糖类的食物是_____。
(2)走进厨房,你会发现煤气罐被管道天然气代替了,天然气属于_____能源(选填“可再生”或“不可再生”),其主要成分在空气中充分燃烧的化学方程式为_____。
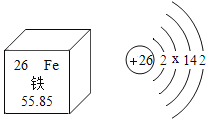
(3)使用铁强化酱油可预防贫血,铁属于人体所需的_____(选填“常量”或“微量”)元素;铁元素的原子结构示意图以及在元素周期表中信息如图,相对原子质量为_____,x=_____。
(4)加了洗涤剂的水洗涤油腻的碗筷既快捷又干净,这是由于洗涤剂具有_____功能。
【题目】许多在水溶液的反应(如复分解反应),往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象。下表为相同温度下某些物质的溶解度:
物质 | AgCl (白色) | Ag2S (黑色) | CaSO4 (白色) | Ca(OH)2 (白色) | Ca(HCO3)2(白色) | CaCO3 (白色) | (NH4)2SO4 无色透明 |
溶解度/g | 1.5×10-4 | 1.3×10-6 | 0.2 | 0.165 | 16.6 | 0.0015 | 75.4 |
(1)若在含有氯化银固体的水中加入硫化钠溶液,可能发生的现象是 _________。
(2)生产硫酸铵化肥的方法之一是:把石膏(CaSO42H2O)粉悬浮于水中,不断通入氨气再通入二氧化碳,充分反应后,立即过滤,滤液经蒸发而得到硫酸铵晶体。该反应的化学方程式为_____。
(3)从上表中再寻找两种能够按照上述规律相互转化的物质,写出实现该转化的化学方程式:______ 。