题目内容
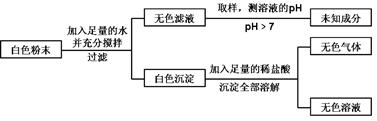
一包白色粉末A由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的三种混合而成。为探究其组成,进行以下实验:
分析实验过程,回答:
①白色粉末A中一定有(8),一定没有(9);可能含有的物质是(10) 生成无色气体E的化学方程式是(11)。
② 对可能含有的物质,通过如下实验进一步确认:

分析实验过程,回答:
①白色粉末A中一定有(8),一定没有(9);可能含有的物质是(10) 生成无色气体E的化学方程式是(11)。
② 对可能含有的物质,通过如下实验进一步确认:
| 实验操作 | 实验现象 | 实验结论 |
| 取未知成分溶液D少许,加入(12)溶液, | (13) | (14)。 |
(8)碳酸钙、氢氧化钠 (9)硫酸铜 (10)BaCl2或Na2SO4
(11)CaCO3+2HCl==CaCl2+H2O+CO2↑ (12)氯化钡(硫酸或硫酸钠等)
(13) 白色沉淀(或没有沉淀) (14)有硫酸钠 (氯化钡)
(11)CaCO3+2HCl==CaCl2+H2O+CO2↑ (12)氯化钡(硫酸或硫酸钠等)
(13) 白色沉淀(或没有沉淀) (14)有硫酸钠 (氯化钡)
试题分析:解答叙述型的实验推断题,要根据实验过程中出现的特殊现象,再结合一些物质本身的特性来进行推断,将白色粉末A加足量水,溶解过滤后:1、得到无色滤液,可判断一定不存在硫酸铜,因为它的水溶液呈蓝色,并且溶液的PH>7,说明一定存在氢氧化钠,2、滤渣为白色沉淀,且在白色沉淀中加入足量的稀盐酸,沉淀全部溶解,可以判断原白色粉末中一定有碳酸钙,而BaCl2或Na2SO4,只可能存在其中的一种,因为如果同时存在,会相互反应生成白色沉淀硫酸钡,而它不溶于稀盐酸
①白色粉末A中一定有碳酸钙、氢氧化钠,一定没有硫酸铜;可能含有的物质是BaCl2或Na2SO4,生成无色气体E的化学方程式是:CaCO3+2HCl==CaCl2+H2O+CO2↑
②要确定是否存在BaCl2,可取未知成分溶液D少许,加入硫酸或硫酸钠等溶液,若出现白色沉淀,则有BaCl2,若没有白色沉淀出现,则没有BaCl2;要确定是否存在硫酸钠,可取未知成分溶液D少许,加入BaCl2等溶液,若出现白色沉淀,则有硫酸钠,若没有白色沉淀出现,则没有硫酸钠

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目