题目内容
现有20%的氯化钠溶液,根据“20%”这一数值,你可以知道该溶液( )A.溶质质量为20g
B.溶液质量为100g
C.水的质量为80g
D.溶质:溶剂:溶液 (质量比)=1:4:5
【答案】分析:根据溶液的组成(溶液由溶质、溶剂组成)以及溶液的质量分数进行解答.
解答:解:A、题目中没有提到20%的氯化钠溶液的质量,所以无法计算该溶液的溶质的质量;故本选项不符合题意;
B、题目中没有提到20%的氯化钠溶液的质量;故本选项不符合题意;
C、题目中没有提到20%的氯化钠溶液的质量,所以无法计算该溶液的溶剂的质量;故本选项不符合题意;
D、20%的氯化钠溶液中,溶质的质量为该溶液的20%、溶剂的质量为该溶液的1-20%=80%,则溶质:溶剂:溶液 (质量比)=20%:80%:100%=1:4:5;故本选项符合题意;
故选D.
点评:解答该题时,需要知道溶液的组成:溶液是由溶质和溶剂组成.
解答:解:A、题目中没有提到20%的氯化钠溶液的质量,所以无法计算该溶液的溶质的质量;故本选项不符合题意;
B、题目中没有提到20%的氯化钠溶液的质量;故本选项不符合题意;
C、题目中没有提到20%的氯化钠溶液的质量,所以无法计算该溶液的溶剂的质量;故本选项不符合题意;
D、20%的氯化钠溶液中,溶质的质量为该溶液的20%、溶剂的质量为该溶液的1-20%=80%,则溶质:溶剂:溶液 (质量比)=20%:80%:100%=1:4:5;故本选项符合题意;
故选D.
点评:解答该题时,需要知道溶液的组成:溶液是由溶质和溶剂组成.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息计算:
| 硫酸(500mL) 品名 硫酸 化学式 H2SO4 相对分子质量98 密度 1.84g/cm3 质量分数98%(1)该试剂瓶中硫酸溶液的质量是 (2)某固体物质由氯化钠和氯化钡组成,取32.8g该固体混合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图所示关系,计算32.8g固体混合物中氯化钠和氯化钡的质量.(H2SO4+BaCl2═BaSO4↓+2HCl) 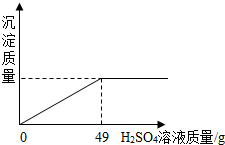
|

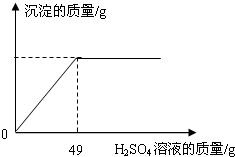
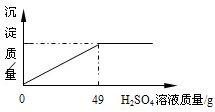 现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:
现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算: