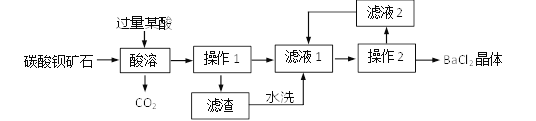
题目内容
【题目】(发现问题)某校化学兴趣小组同学在检验二氧化碳气体的实验过程中,意外发现随着二氧化碳气体的持续通入,变浑的石灰水又逐渐变澄清。
(查阅资料1)向澄清石灰水中持续通入二氧化碳,会先后发生以下两个反应:先发生的反应化学方程式为________________________,导致澄清石灰水变浑浊;后发生的反应化学方程式为CO2+H2O+CaCO3=Ca(HCO3)2,其中Ca(HCO3)2常温下可溶,导致浊液又变澄清。
(类比思考)该小组同学又提出:“向NaOH溶液中持续通入CO2是否也会发生类似的反应呢?”
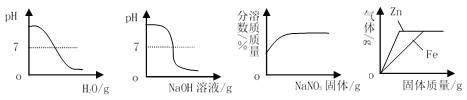
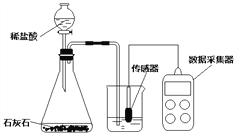
(实验设计)室温(约20℃)下,将10gNaOH溶于80g水中,然后向其中持续平稳的通入二氧化碳气体,同时用数字传感器测定溶液的pH变化,采集数据并绘制图像 。
(查阅资料2)
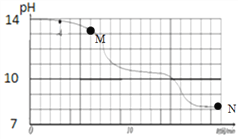
①根据本实验中数据,溶液中溶质若只有NaOH,溶液pH约为14;若只有Na2CO3,溶液pH约为11.6;若只有NaHCO3,溶液pH约为8.3
②20℃时,NaHCO3溶解度约为9.6g
(反思交流)
(1)实验中,用“分液漏斗”而不用“长颈漏斗”的原因是_______________________;
(2)锥形瓶中发生反应的化学方程式为_______________________________;
(3)根据资料和图像判断:M点溶质应为______________(填化学式,下同),N点溶质应为___________;
(4)同学们多次重复实验,所得实验结果基本一致。实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时烧杯内的现象是____________________;
(5)待pH不再变化后,取适量溶液,向其中滴加几滴稀盐酸,立即产生气泡,该反应的化学方程式为________________________________。
【答案】 CO2 + Ca(OH)2 = CaCO3↓+ H2O 控制反应速率(或控制CO2气流速率) CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ NaOH和Na2CO3 NaHCO3 溶液变浑(或有晶体析出) NaHCO3+HCl=NaCl+ H2O+CO2↑
【解析】【查阅资料1】根据二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水解答;【反思交流】(1)根据分液漏斗能控制反应速率(或控制CO2气流速率)解答;(2)根据碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳解答;(3)(4)根据图像结合【查阅资料2】分析解答;(5)根据碳酸氢钠与稀盐酸反应生成氯化钠、水和二氧化碳解答。【查阅资料1】二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,反应的化学方程式为CO2 + Ca(OH)2 = CaCO3↓+ H2O;【反思交流】(1)实验中,用“分液漏斗”而不用“长颈漏斗”的原因是控制反应速率(或控制CO2气流速率);(2)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3 + 2HCl = CaCl2 + H2O + CO2↑;(3)由【查阅资料2】①根据本实验中数据,溶液中溶质若只有NaOH,溶液pH约为14;若只有Na2CO3,溶液pH约为11.6;若只有NaHCO3,溶液pH约为8.3。由图可知,M点时13<pH<14,N点时8<pH<9。故M点溶质应为NaOH和Na2CO3;N点溶质应为NaHCO3;(4)由【查阅资料2】②20℃时,NaHCO3溶解度约为9.6g。18min后溶液的pH基本不再变化,则此时烧杯内的现象是溶液变浑(或有晶体析出);(5)碳酸氢钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为NaHCO3+HCl=NaCl+ H2O+CO2↑。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案