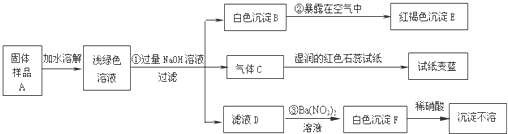
题目内容
在一次化学探究活动中,晓琴同学无意中发现,两种无色溶液混合后,能产生一种白色沉淀.
(1)从无色溶液着手研究,若有一种是稀硫酸,则白色沉淀是______,其化学方程式是______.
(2)从白色沉淀着手研究,向其中加入稀硝酸,沉淀溶解,则白色沉淀的可能是______,其化学方程式是______.
(1)从无色溶液着手研究,若有一种是稀硫酸,则白色沉淀是______,其化学方程式是______.
(2)从白色沉淀着手研究,向其中加入稀硝酸,沉淀溶解,则白色沉淀的可能是______,其化学方程式是______.
(1)若有一种是稀硫酸,因为硫酸根离子是用钡离子来验证的,因此白色沉淀是硫酸钡,其化学方程式是:氯化钡(或硝酸钡)与硫酸反应生成硫酸钡白色沉淀和盐酸(或硝酸).故答案为:BaSO4;BaCl2+H2SO4=BaSO4↓+2HCl
(2)从白色沉淀着手研究,向其中加入稀硝酸,沉淀溶解,白色沉淀一定不是硫酸钡,而可能是碳酸钡,因为碳酸钡能够溶于三大强酸;碳酸钡和硝酸反应生成硝酸钡和水和二氧化碳.故答案为:BaCO3;BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
(2)从白色沉淀着手研究,向其中加入稀硝酸,沉淀溶解,白色沉淀一定不是硫酸钡,而可能是碳酸钡,因为碳酸钡能够溶于三大强酸;碳酸钡和硝酸反应生成硝酸钡和水和二氧化碳.故答案为:BaCO3;BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
①请你分析上述方案中为什么强调只有测得的PH≥7才能证明反应发生了?______.
②写出稀盐酸与氢氧化钠溶液反应的化学方程式______.
(2)设计实验,探究稀盐酸与氢氧化钠溶液的反应是否放热提供的实验仪器与药品:
10%的盐酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
(3)探究稀盐酸与氢氧化钠溶液是否恰好完全反应请你完成实验方案设计:
第二组同学在做完稀盐酸与氢氧化钠溶液反应的实验后,为探究稀盐酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二:
此时有同学提出方案二不能证明稀盐酸与氢氧化钠溶液恰好完全反应,其原因是______.
为此,还需要选择______(填一种试剂),再进行实验即可.
(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
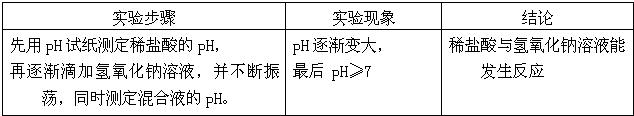
| 实验步骤 | 实验现象 | 结论 |
| 先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的pH. | pH逐渐变大,最后pH≥7 | 稀盐酸与氢氧化钠溶液发生反应 |
②写出稀盐酸与氢氧化钠溶液反应的化学方程式______.
(2)设计实验,探究稀盐酸与氢氧化钠溶液的反应是否放热提供的实验仪器与药品:
10%的盐酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
(3)探究稀盐酸与氢氧化钠溶液是否恰好完全反应请你完成实验方案设计:
第二组同学在做完稀盐酸与氢氧化钠溶液反应的实验后,为探究稀盐酸与氢氧化钠溶液是否恰好完全反应,设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若______________ | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀盐酸与氢氧化钠溶液恰好完全反应 |
为此,还需要选择______(填一种试剂),再进行实验即可.

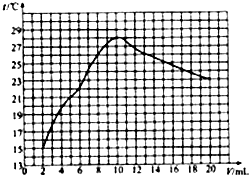
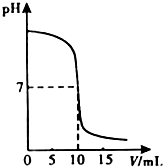 (2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.
(2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.