题目内容
【题目】学习化学要善于总结物质之间的关系.A、B、C是初中化学常见物质,它们之间有如图所示的转化关系(部分物质和反应条件已经略去,→表示生成).

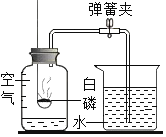
(1)若A、B、C中都含有人体中含量最多的金属元素,并且A可用作干燥剂,则:B转化成C的过程在实验室中的应用是____________.
(2)若A是一种单质,C是蓝色溶液,则:C转化成A的反应所属的基本反应类型是________;B转化成C的化学方程式为____________.
【答案】检验二氧化碳 置换反应 CuO+H2SO4═CuSO4+H2O(合理即可)
【解析】
根据题干提供的信息进行分析解答,若人体中含量最多的金属元素是钙元素,A是含钙的可以用作干燥剂的物质,故A是氧化钙,据此进行分析;若C是蓝色溶液,则C中含有铜离子,据此分析。
(1)人体中含量最多的金属元素是钙元素,A是含钙的可以用作干燥剂的物质,故A是氧化钙,氧化钙能生成B,B能生成C,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,故B是氢氧化钙,C是碳酸钙,氢氧化钙转化为碳酸钙在实验室可以用作检验二氧化碳的存在;
(2)A是一种单质,C是蓝色溶液,则C中含有铜离子,转化生成的单质可以是铜,铜能与氧气反应生成氧化铜,氧化铜能与酸反应生成蓝色的铜盐溶液,故A是铜,B是氧化铜,C可能是硫酸铜,C转化成A的反应是硫酸铜能与铁反应生成铜,该反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,属于置换反应,氧化铜能与硫酸反应生成硫酸铜,反应的化学方程式是CuO+H2SO4═CuSO4+H2O。

【题目】实验小组对过氧化氢制取氧气中影响反应速率的因素进行探究。
[提出问题] 哪些因素可能影响该反应的反应速率?
[作出猜想] 小芳同学:H2O2溶液的浓度可能影响该反应的反应速率;
小华同学:催化剂(MnO2)的用量可能影响该反应的反应速率……
[实验验证]
(1)为了探究在其他条件相同时H2O2溶液浓度对反应速率的影响,小芳同学的实验是:每次均取10mL30%的H2O2溶液,然后配成不同浓度的溶液,在相同温度下加入等质量MnO2进行实验,测定各次收集到100mL氧气时所用的时间,记录数据如下:
实验次序 | 1 | 2 | 3 | 4 | 5 |
H2O2溶液浓度 | 1% | 5% | 15% | 25% | 30% |
所用时间(秒) | 660 | 205 | 25 | 4 | 3 |
通过上表实验数据分析可得到的结论是:在其他条件相同的情况下,_____越大,反应速率越_____。
(2)为了探究在其他条件相同时催化剂(MnO2)的用量对反应速率的影响,小华同学的实验是:每次均用30mL10%的H202溶液在相同温度下进行实验,采用不同量MnO2粉末做催化剂,测定各次收集到100mL氧气时所用的时间,绘图如下:
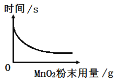
①该反应的化学方程式为:__________
②通过如图实验数据分析可得到的结论是: ________
(3)小明同学认为其他条件也可能会影响该反应的速率。
小明同学的实验是:每次均取10mL30%的H2O2溶液,然后配成一定浓度的溶液进行实验。
实验次序 | 1 | 2 | 3 | 4 | 5 |
H2O2溶液浓度 | ① | 10% | 10% | 10% | 10% |
二氧化锰粉末用量/g | 0.2 | 0.2 | ② | 0.2 | 0.2 |
温度/℃ | 20 | 30 | 40 | 50 | 60 |
待测数据 |
填写表中数据:① ___________ ② ___________。
③小明同学实验探究的目的是 _________。
④以下待测数据合理的是_____________
A.测定各次实验收集到100mL氧气时所用的时间
B.测定各次实验在30s里收集到的氧气体积
C.测定各次实验完全反应时收集到的氧气体积
【题目】空气是一种宝贵的资源,空气中含氧气的体积为 21%,这是制取氧气的廉价、易得的原料。工业制取氧气的流程如下:
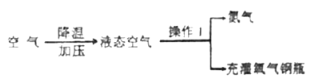
(1)氧气有很多用途。下列属于氧气用途的是_______________(填序号)

(2)操作 1 的名称是_________________;
(3)工业制取氧气的变化属于____________(填“物理”或“化学”)变化;
(4)充灌氧气钢瓶的气体属于_________________(填“纯净物”或“混合物”);
(5)根据下表数据判断:工业上制取氧气,控制温度在-195.8℃<T<______℃时,可以将液态空气中的氮气分离。
物质 | H2 | CO2 | N2 | O2 |
沸点/℃ | -252.8 | -56.55 | -195.8 | -183.0 |
【题目】过氧化氢在生产生活中有广泛应用。实验小组对过氧化氢的某些性质进行研究。
Ⅰ.不稳定性
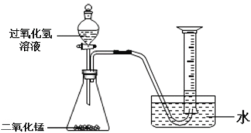
(1)如上图所示进行实验,过氧化氢分解的化学方程式为______。
(2)能用排水法收集O2的原因是______。
(3)探究温度对过氧化氢分解速率的影响。
同学们进行了如下的实验,实验数据如下表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度 % | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
反应时间 | 40 min | 40 min | 40 min |
由此得出的结论是______。
Ⅱ.腐蚀性
(查阅资料)H2O2溶液有腐蚀性。
(进行实验)
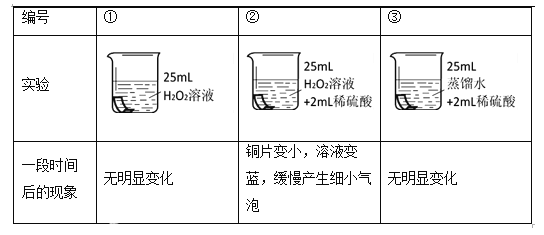
同学们用铜片设计实验验证H2O2溶液的腐蚀性。(各组实验中H2O2溶液和稀硫酸所用浓度均相同)
将铜片分别浸泡在3种溶液中进行实验,如下表。
(解释与结论)
(4)实验①的作用是______。
(5)能说明铜片被腐蚀与H2O2溶液和稀硫酸均有关的实验组是______。
(6)铜片被腐蚀的反应如下,补全该反应的化学方程式。Cu + H2O2+ H2SO4=== CuSO4 +□_______/p>