题目内容
某炼铁厂在高温条件下利用一氧化碳还原赤铁矿(主要成分是Fe2O3)。现有100t的赤铁矿,理论上可炼得纯铁56t。(反应的化学方程式:3CO+Fe2O3 2Fe+3CO2)计算:
2Fe+3CO2)计算:
(1)CO中碳元素和氧元素的质量比_________;
(2)求赤铁矿中Fe2O3的质量分数。
 2Fe+3CO2)计算:
2Fe+3CO2)计算:(1)CO中碳元素和氧元素的质量比_________;
(2)求赤铁矿中Fe2O3的质量分数。
(1)3∶4(或12∶16)
(2)解:设100t赤铁矿中含Fe2O3的质量为X
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
160 2×56
X 56t

X=80t
赤铁矿中Fe2O3的质量分数为: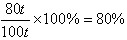
答:赤铁矿中Fe2O3的质量分数是80%。
(2)解:设100t赤铁矿中含Fe2O3的质量为X
3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2160 2×56
X 56t

X=80t
赤铁矿中Fe2O3的质量分数为:
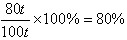
答:赤铁矿中Fe2O3的质量分数是80%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Fe+3CO2)
2Fe+3CO2) 2Fe+3CO2)
2Fe+3CO2) 2Fe+3CO2)
2Fe+3CO2) 2Fe+3CO2)
2Fe+3CO2)