题目内容
某炼铁厂在高温条件下利用一氧化碳还原赤铁矿(主要成分是Fe2O3).现有100t的赤铁矿,理论上可炼得纯铁56t.(反应的化学方程式:3CO+Fe2O3
| ||
计算:
(1)CO中碳元素和氧元素的质量比
(2)求赤铁矿中Fe2O3的质量分数.
分析:(1)根据元素的质量比是相对原子质量乘以原子个数之比进行计算
(2)根据铁的质量和化学方程式可求得Fe2O3的质量,然后
×100%,而求得赤铁矿中Fe2O3的质量分数
(2)根据铁的质量和化学方程式可求得Fe2O3的质量,然后
| 氧化铁的质量 |
| 赤铁矿的质量 |
解答:解:(1)CO中碳元素和氧元素的质量比为:12:16═3:4
故答案为:3:4
(2)解:设100t赤铁矿中含Fe2O3 的质量为X
3CO+Fe2O3
2Fe+3CO2
160 2×56
X 56t
=
X=80t
赤铁矿中Fe2O3的质量分数为:
×100%=80%
答:赤铁矿中Fe2O3的质量分数是80%.
故答案为:3:4
(2)解:设100t赤铁矿中含Fe2O3 的质量为X
3CO+Fe2O3
| ||
160 2×56
X 56t
| 160 |
| 2×56 |
| X |
| 56t |
X=80t
赤铁矿中Fe2O3的质量分数为:
| 80t |
| 100t |
答:赤铁矿中Fe2O3的质量分数是80%.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
 2Fe+3CO2)
2Fe+3CO2) 2Fe+3CO2)
2Fe+3CO2) 2Fe+3CO2)
2Fe+3CO2)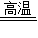 2Fe+3CO2)
2Fe+3CO2)