题目内容
【题目】由氯化钡废液(杂质为FeCl3及微量NaCl)制备产品BaCl22H2O的流程如图。
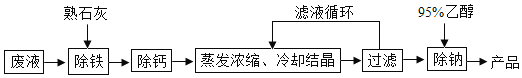
(1)FeCl3中铁元素的化合价是______________。
(2)煅烧石灰石制取生石灰的化学方程式为______________________,生石灰变成熟石灰的过程是_____________过程(填“吸热”或“放热”),石灰水能使紫色石蕊试液变___色。石灰石和熟石灰中常用于改良酸性土壤的是__________________。
(3)用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl,C2H6O是_____化合物(填“有机”或“无机”)。C2H6O在O2中完全燃烧生成CO2和__________。煤、氢气、乙醇三种燃料中,最清洁的是___________。
(4)结合流程和表回答:工业上选择25℃而不选择5 ℃进行冷却结晶的主要原因是:①滤液多次循环后,25 ℃与5 ℃结晶产品的总产率基本相同;②_______。
表:每次结晶时,温度对产品纯度和产率的影响
冷却结晶的温度/℃ | 产品的纯度/% | 产品的产率/% |
5 | 99 | 72 |
25 | 99 | 60 |
【答案】+3 CaCO3![]() CaO+CO2↑ 放热 蓝 熟石灰 有机 H2O 氢气 25℃是常温,不需要降温
CaO+CO2↑ 放热 蓝 熟石灰 有机 H2O 氢气 25℃是常温,不需要降温
【解析】
(1)FeCl3中,氯元素显-1价,根据化合物中各元素化合价的代数和为零可知,铁元素的化合价是+3;
(2)石灰石煅烧生成生石灰和二氧化碳,反应的化学方程式为CaCO3![]() CaO+CO2↑,生石灰变成的熟石灰的过程是放热过程放热,氢氧化钙水溶液呈碱性,石灰水能使紫色石蕊试液变蓝色。熟石灰具有碱性,石灰石和熟石灰中常用于改良酸性土壤的是熟石灰;
CaO+CO2↑,生石灰变成的熟石灰的过程是放热过程放热,氢氧化钙水溶液呈碱性,石灰水能使紫色石蕊试液变蓝色。熟石灰具有碱性,石灰石和熟石灰中常用于改良酸性土壤的是熟石灰;
(3)C2H6O是含碳化合物,属于有机化合物;C2H6O在O2中完全燃烧生成CO2和H2O;氢气燃烧生成水,无污染,煤、氢气、乙醇三种燃料中,氢气燃烧产物是水,对环境无任何影响,故最清洁的是氢气;
(4)工业上选择25℃而不选择5℃进行冷却结晶的主要原因是①滤液多次循环后,25℃与5℃结晶产品的总产率基本相同:②25℃是常温,不需要降温。

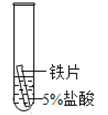
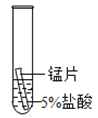
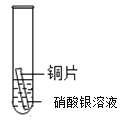
【题目】某研究小组为探究铁、铜、锰(Mn)、银的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用溶液的体积相同)。下列判断不正确的是
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 立即产生气泡,速率较快 | 铜片的表面有银白色固体,一段时间后。溶液由无色变为蓝色 |
A.通过实验一和实验二的反 应剧烈程度,能判断出铁和锰的金属活动性强弱
B.在上述三个实验基础上再增加一个铜和5%盐酸的实验,则能判断出四种金属的活动性顺序
C.通过上述三个实验,能判断出四种金属的活动性顺序
D.通过实验三的反应现象,能判断出铜和银的金属活动性强弱