题目内容
【题目】铝、镁等金属在生产生活中有广泛的应用。
(一)铝制品的应用
(1)Cu、Fe、Al三种金属的活动性由强到弱的顺序是______。
(2)用玻璃钢、铝合金等材料可制成某火箭整流罩,以上叙述中不涉及到______(选填字母)。
A无机材料 B合成材料 C复合材料
(3)焊接铁轨时,铝与氧化铁在高温下生成铁和氧化铝,该反应的化学方程式______。
(4)铝制成铝箔作食品包装,是利用它的______。(选填字母)。
A导热性 B延展性 C导电性
(二)氧化铝的制备
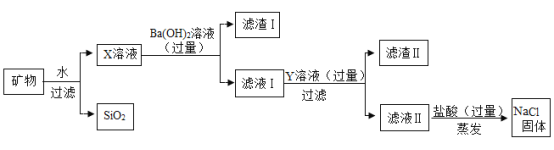
活性氧化铝可用作化学反应的催化剂。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如图:
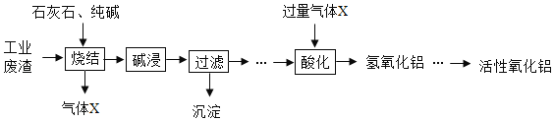
(1)将工业废渣研磨成粉末的目的是______。
(2)气体X的化学式______。
(3)碱浸过程中,烧结生成的NaFeO2可与水反应生成NaOH和另一种碱,该含铁化合物为______。
(三)探究铝碳酸镁的组成
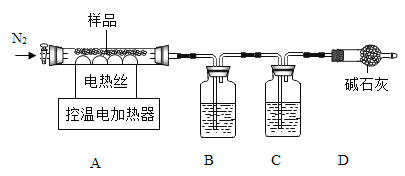
铝碳酸镁[AlxMgy(OH)zCO3aH2O]可用于治疗胃酸过多。某兴趣小组取一定量该药片用如图装置探究其组成。
(资料)①Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O.
②Mg(OH)2不溶于NaOH,NaAlO2极易溶于水。
(1)装配好实验装置后,先要______。
(2)铝碳酸镁加热分解为Al2O3、MgO、CO2和水,装置B和C中盛放的药品应选择:______。
A浓NaOH溶液、浓H2SO4B浓H2SO4、浓NaOH溶液
(3)实验开始前通入一定量氮气,目的是______。
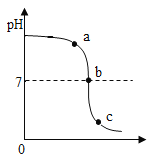
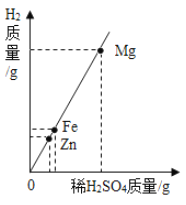
(4)充分加热后,测得装置B增重2.16g,装置C增重0.44g。另取等质量的样品加入一定量稀硫酸充分反应后滤去不溶物,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。
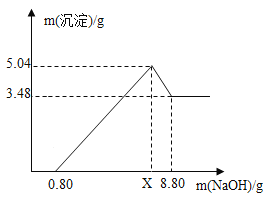
①图中NaOH加入0.80g,仍没有沉淀,说明滤液中含______。
②X值为______。
③x:y:z=______。
④写出铝碳酸镁治疗胃酸过多的化学方程式______。
【答案】Al>Fe>Cu AB 2Al+Fe2O3![]() 2Fe+Al2O3 B 增大反应物的接触面积,使反应更快更充分 CO2 Fe(OH)3 检查装置气密性 B 排尽装置中的空气,防干扰 H2SO4 8 2:6:16 Al2Mg6(OH)16CO3·4H2O+18HCl=2AlCl3+6MgCl2+21H2O+CO2↑
2Fe+Al2O3 B 增大反应物的接触面积,使反应更快更充分 CO2 Fe(OH)3 检查装置气密性 B 排尽装置中的空气,防干扰 H2SO4 8 2:6:16 Al2Mg6(OH)16CO3·4H2O+18HCl=2AlCl3+6MgCl2+21H2O+CO2↑
【解析】
(一)
(1)Cu、Fe、Al三种金属的活动性由强到弱的顺序是Al>Fe>Cu。
(2)玻璃钢是由玻璃纤维与塑料复合而成的,属于复合材料,铝合金属于合金材料,故不涉及的是无机材料、合成材料,故选AB。
(3)焊接铁轨时,铝与氧化铁在高温下生成铁和氧化铝,该反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。
(4)铝制成铝箔作食品包装,是利用它的延展性,故选B。
(二)
(1)由于反应物之间接触面积越大,反应越快,转化率越高,所以将工业废渣研磨成粉末的目的是增大反应物的接触面积,使反应更快更充分。
(2)石灰石在烧结过程中分解为氧化钙和二氧化碳,所以气体X的化学式CO2。
(3)碱浸过程中,烧结生成的NaFeO2可与水反应生成NaOH和一种含铁的化合物,根据质量守恒定律、碱的组成,由于在碱性溶液中同时生成且铁为正三价,所以该含铁的化合物Fe(OH)3。
(三)
(1)装配好实验装置后,先要检查装置气密性。
(2)铝碳酸镁片在加热条件下分解生成Al2O3、MgO、CO2、H2O,装置B中应放入能吸水的物质,但不能吸收二氧化碳气体,否则无法确定生成的水和二氧化碳各自的质量进行分析,装置C中应放入吸收二氧化碳的物质,装置B中盛放浓H2SO4,装置C中盛放浓NaOH溶液,故选B。
(3)为减小误差,实验开始前通入一定量氮气,目的是排尽装置中的空气,防干扰。
(4)①氢氧化钠和硫酸反应生成硫酸钠和水,图中NaOH加入0.80g,仍没有沉淀,说明滤液中含未反应完的稀硫酸。
②由图象分析,NaOH加入0.80g,仍没有沉淀,说明滤液含硫酸,当加入NaOH的质量到X时,生成的沉淀有氢氧化镁和氢氧化铝;根据题目提供的资料可知,Mg(OH)2不溶于NaOH,Al(OH)3能溶于NaOH,生成的NaAlO2极易溶于水,所以沉淀3.48g为Mg(OH)2,Al(OH)3的质量量为5.04g-3.48g=1.56g;设与硫酸镁反应的氢氧化钠的质量为x,与硫酸铝反应的氢氧化钠的质量为y



故X=4.8g+2.4g+0.8g=8g
③根据质量守恒定律,反应前后元素的质量不变,根据以上数据,3.48gMg(OH)2中镁元素的质量=![]() ,Al(OH)3的质量1.56g,铝元素的质量=
,Al(OH)3的质量1.56g,铝元素的质量=![]() ,原子个数比为
,原子个数比为![]() ,根据元素化合价代数和为零的原则,可知OH-的个数为16,所以铝碳酸镁的化学式为Al2Mg6(OH)16 CO34H2O,x:y:z=2:6:16。
,根据元素化合价代数和为零的原则,可知OH-的个数为16,所以铝碳酸镁的化学式为Al2Mg6(OH)16 CO34H2O,x:y:z=2:6:16。
④铝碳酸镁治疗胃酸过多的化学方程式为:Al2Mg6(OH)16CO3·4H2O+18HCl=2AlCl3+6MgCl2+21H2O+CO2↑。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】2020年面对突如其来的新型冠状病毒,越来越多的人意识到日常清洁消毒的重要性。医用酒精、84消毒液成为每个家庭必备的消毒用品。
交流与讨论一、关于酒精:
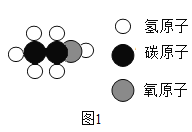
(1)下图是酒精(C2H5OH)分子的微观模拟图1,酒精的学名是_____,属于_____(填序号)。
A 化合物 B 氧化物 C 无机物 D 有机物
(2)酒精可作燃料,燃烧时放出大量的热,其化学反应方程式为_____,使酒精具备能燃烧这一性质的微粒是_____(填微粒名称);熄灭酒精灯时用灯帽盖灭,依据的灭火原理是_____。
(3)酒精是可再生能源,利用农作物秸秆生产酒精的主要流程如图2所示,请回答下列问题:
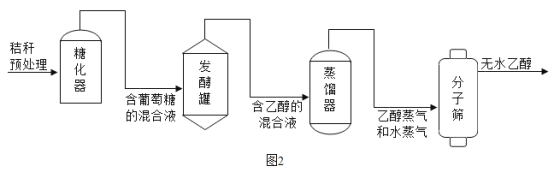
发醇罐中,葡萄糖(C6H12O6)在酒化酶的催化作用下发生反应的化学方程式为:C6H12O6 2C2H5OH+2X↑,则X的化学式为_____,该反应属于_____反应(填基本反应类型)。
2C2H5OH+2X↑,则X的化学式为_____,该反应属于_____反应(填基本反应类型)。
(4)医用体积分数75%的酒精溶液作消毒剂,此酒精溶液的溶剂是_____(填物质名称)。
[查阅资料]配制100mL医用酒精,可以量取79mL 95%的酒精溶液,并加水稀释至100mL。
I.量取75mL 95%的酒精溶液,可选用的仪器是_____(如图所示,填序号)。
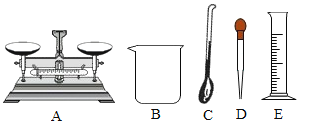
Ⅱ.小明将79mL 95%酒精溶液和21mL蒸馏水混合,发现体积小于100mL,请用微粒的观点解释其原因_____。
Ⅲ.在老师的指导下,小明选用容量瓶(可精确地配制一定浓度溶液的仪器)79mL 95%的酒精溶液并加水至10mL刻度配制75%的酒精溶液。
交流与讨论二、关于“84消毒液”:
“84消毒液”说明书上的部分信息如下:
主要成分:NaClO
杂质成分:NaCl、NaOH
净含量:500mL
主要性能:具有碱性、漂白性和腐蚀性
保存方法:密封、避光、低温保存
使用范围:适用于一般物体的表面消毒
注意事项:不可与其他洗涤剂或消毒液混合使用
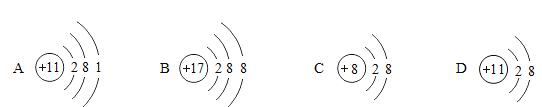
(1)NaCl、NaClO、NaOH中阳离子的结构示意图为_____(填序号)。
(2)常温下,该消毒液的pH_____(填序号)。
A 大于7
B 等于7
C 小于7
(3)工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,反应后形成了NaCl和NaClO的溶液,该反应的化学方程式为_____。
(4)“84消毒液”(主要成分是NaClO) 和洁厕剂(主要成分是盐酸) 混合使用会产生有毒气体,可能导致中毒,小美猜想有毒气体可能是氯气,她猜想的依据是_____。
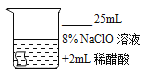
(5)探究NaClO的漂白性
[查阅资料]
次氯酸钠(NaClO) 能与水反应,水溶液能释放氧气,反应的过程为NaClO+H2O=HClO+NaOH;2HClO![]() 2HCl+O2↑,该过程中化合价发生变化的元素有_____,次氯酸(HClO) 能使染料和有机色质褪色,可用作漂白剂。
2HCl+O2↑,该过程中化合价发生变化的元素有_____,次氯酸(HClO) 能使染料和有机色质褪色,可用作漂白剂。
[进行实验]选用红色纯棉布条进行如图实验:
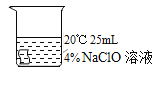
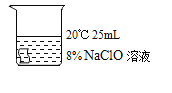
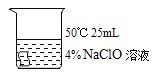
编号 | ① | ② | ③ | ④ |
实验操作 |
|
|
|
|
5min后 | 布条略变浅 | 布条变为粉色 | 布条变为粉色 | 布条变为乳黄色 |
[解释与结论]
I.实验中,欲得出“其他条件相同时,升高温度可使次氯酸钠溶液的漂白性增强”的结论,需要对比_____。
实验(填编号):
Ⅱ.试分析实验④应控制的温度条件及设计该实验的目的是_____。
Ⅲ.根据实验,请你再提出一条使用“84消毒液”消毒时的注意事项_____。