题目内容
控制变量法是实验探究的重要方法。下列设计方案探究目的不能实现的是
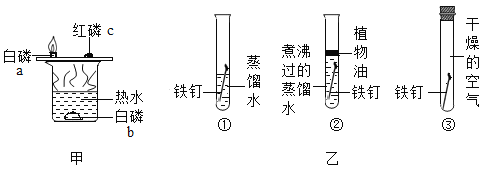
A.甲可探究可燃物的燃烧是否需要与氧气接触
B.甲可探究可燃物的燃烧是否需要达到一定温度
C.乙中①③对比可探究铁的锈蚀条件与氧气是否有关
D.乙中①②③对比可探究铁的锈蚀条件与氧气和水等物质是否有关
氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
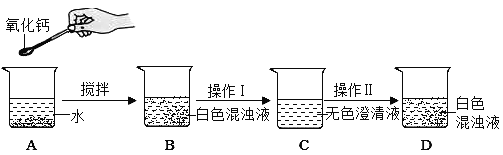
(1)A中发生反应的化学方程式为_____。分离B中难溶物的操作Ⅰ叫_____
(2)如果要用实验证明C中不是水而是一种溶液,可以选择下列_____(填序号)进行实验。
①稀盐酸 ②酚酞试液 ③二氧化碳 ④氯化钠溶液
(3)操作Ⅱ是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是_____;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是_____。
(查阅资料)工业铁红主要成分是Fe2O3,还含有少量的FeO,Fe3O4
(1)草酸晶体(H2C2O4,·3H2O)在浓硫酸作用下受热分解,化学方程式_____。
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(问题讨论)为了测定铁红中铁的质量分数,小组同学进行如下实验。(装置气密性良好)
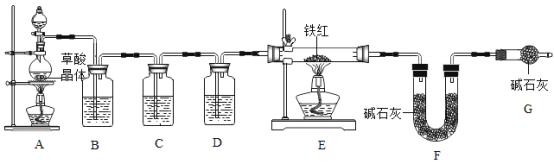
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(2)C装置的作用是_____。
(3)写出E装置中所发生反应的一个化学方程式:_____。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为m g,则_____<m<_____。
②若实验前后称得F装置增重7.7g,则此铁红中铁的质量分数是_____
(实验反思)
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”或“偏大”)。
(2)该实验装置的一个明显缺陷是_____。


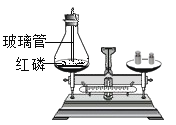 验证质量守恒定律 B.
验证质量守恒定律 B. 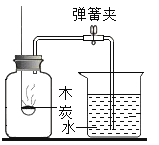 测定空气中氧气含量 C.
测定空气中氧气含量 C. 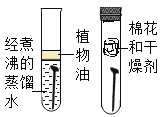 探究铁钉锈蚀的条件 D.
探究铁钉锈蚀的条件 D.  探究燃烧条件之一:温度达到着火点
探究燃烧条件之一:温度达到着火点 ”、“
”、“  ”、“
”、“  ”表示不同的原子。下列说法错误的是
”表示不同的原子。下列说法错误的是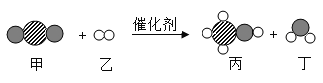

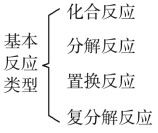 化学反应分类 B.
化学反应分类 B.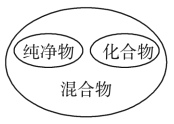 物质分类
物质分类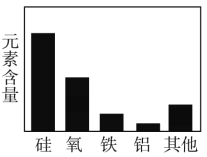 地壳中元素含量 D.
地壳中元素含量 D.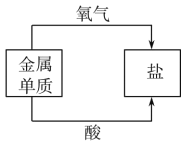 金属的化学性质
金属的化学性质