题目内容
【题目】下列四个图象能正确反映其对应实验操作的是( )
A. 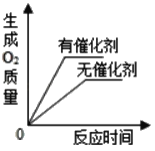 用2份完全相同的双氧水制取氧气
用2份完全相同的双氧水制取氧气
B. 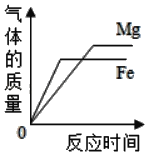 向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片
向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片
C. 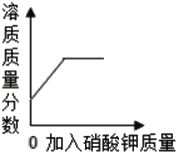 向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体(温度不变)
向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体(温度不变)
D. 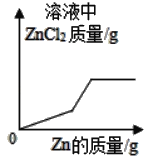 向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒
向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒
【答案】C
【解析】
A、过氧化氢分解生成水和氧气时,利用催化剂时反应速率快,需要时间短,但是等质量的过氧化氢完全反应后得到的氧气质量相等,故不符合题意;
B、向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片时,镁和稀盐酸反应速率快,反应需要时间短,并且镁和稀盐酸反应生成的氢气比铁多,故不符合题意;
C、向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体时,随着硝酸钾的加入,溶质质量分数增大,当达到饱和状态时,溶质质量分数不再变化,故符合题意;
D、锌和氯化亚铁反应生成氯化锌和铁,和氯化铜反应生成氯化锌和铜,反应的化学方程式为及其质量关系为:
![]()
![]()
由以上质量关系可知,向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒时,完全反应前应该是一条直线,不应该出现弯折,故不符合题意。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
(提出问题)氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些 呢?
(设计实验1小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
① | 10.0 g | 330℃ | 100 mL | t1 | |
② | 10.0 g | CuO 1.5 g | 330℃ | 100 mL | t2 |
③ | 10.0 g | MnO2 1.5 g | 330℃ | 100 mL | t3 |
④ | 10.0 g | MnO2 g | 380℃ | 100mL | t4 |
(1)若t1>t2,说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的_________和_________不变。
(2)写出实验④所涉及的化学方程式__________________。
(3)实验④中MnO2的质量为_________g,若t3>t4,则化学反应快慢与温度的关系是_________。
(4)氯酸钾的分解速率可能还与_________因素有关,请设计实验证明_______。
【题目】酸和碱能发生中和反应,它在日常生活和工农业生产中有着广泛的应用。下图表示硫酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线及相关的实验操作。请从中获取信息,回答下列问题:
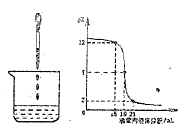
(1)烧杯中盛放的是______溶液。
(2)小明向氢氧化钠溶液中加入稀硫酸,该中和反应的实质是______。然后,对反应过程中废液的溶质进行了如下探究:
(提出问题)氢氧化钠溶液和稀硫酸混合后,溶质是什么?
(查阅资料)硫酸钠溶液呈中性
(猜想假设)猜想I硫酸钠和氢氧化钠;猜想Ⅱ硫酸钠和硫酸;猜想Ⅲ______。
(设计实验)
实验操作 | 实验现象 | 实验结论 |
①取少量废液于试管中,滴入几滴酚酞试液 | 溶液无明显变化 | 猜想______不成立 |
②另取少量废液于试管中,滴入几滴氯化钡溶液 | ______ | 猜想Ⅱ成立 |
(反思与评价)小芳认为实验操作②得出的结论不成立,理由是______。可以改为向废液中加入少量______,溶液变为红色,证明猜想Ⅱ成立