题目内容
【题目】为研究酸的性质,某研究小组进行了如下探究。
(1)小刚将颗粒大小相同的纯锌粒和粗锌粒分别加入相同浓度的稀硫酸中。写出锌与硫酸反应的化学方程式:_____________________________________________。
(2)小刚仔细观察后发现纯锌粒和硫酸的反应明显比粗锌粒慢。通过查阅资料小刚得知粗锌中含有一些不活泼金属,他猜想可能是粗锌粒中不活泼金属促进了锌和硫酸的反应。为了验证小刚的猜想,你认为应该在盛有纯锌粒和稀硫酸的试管中,加入少量的_____________(填序号)。
A.盐酸 B.氯化铜 C.氯化钠 D.氯化钙
(3)实验中小刚发现加入上述第(2)问的选项中的四种物质,纯锌粒和稀硫酸的反应都有不同程度的加快,请你分析可能的原因是___________________________________。
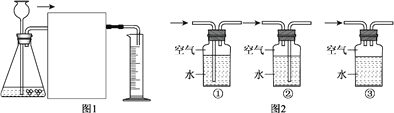
(4)小刚想通过用ag的粗锌粒和足量的稀硫酸反应,测量生成氢气的体积来计算粗锌粒的纯度。设计了如图1所示的实验装置,在虚线框中应接入图2中的______________(填序号),集气瓶上方残留的空气__________________(填“会”或“不会”)对氢气体积的测量造成影响。小刚实验过程中共收集到VmL的氢气(氢气的密度为![]() g/L),则该粗锌粒中锌的质量分数为_____________%(用a、
g/L),则该粗锌粒中锌的质量分数为_____________%(用a、![]() 、V表示)。
、V表示)。
【答案】 Zn+H2SO4═ZnSO4+H2↑ B 四种溶液中的![]() 对溶液起了促进作用 ② 不会
对溶液起了促进作用 ② 不会 ![]()
【解析】(1)将颗粒大小相同的纯锌粒和粗锌粒分别加入相同浓度的稀硫酸中。锌与硫酸反应的化学方程式:Zn+H2SO4═ZnSO4+H2↑。(2)仔细观察后发现纯锌粒和硫酸的反应明显比粗锌粒慢。通过查阅资料得知粗锌中含有一些不活泼金属,可能是粗锌粒中不活泼金属促进了锌和硫酸的反应。为了验证猜想,应该在盛有纯锌粒和稀硫酸的试管中,加入少量的 B.氯化铜。 (3)实验中发现加入上述第(2)问的选项中的四种物质,纯锌粒和稀硫酸的反应都有不同程度的加快,分析可能的原因是四种溶液中的![]() 对溶液起了促进作用 。(4)想通过用ag的粗锌粒和足量的稀硫酸反应,测量生成氢气的体积来计算粗锌粒的纯度。设计了如图1所示的实验装置,在虚线框中应接入图2中的②,集气瓶上方残留的空气不会对氢气体积的测量造成影响。实验过程中共收集到VmL的氢气(氢气的密度为
对溶液起了促进作用 。(4)想通过用ag的粗锌粒和足量的稀硫酸反应,测量生成氢气的体积来计算粗锌粒的纯度。设计了如图1所示的实验装置,在虚线框中应接入图2中的②,集气瓶上方残留的空气不会对氢气体积的测量造成影响。实验过程中共收集到VmL的氢气(氢气的密度为![]() g/L),则该粗锌粒中锌的质量分数为∶解∶设ag的粗锌粒中含锌xg
g/L),则该粗锌粒中锌的质量分数为∶解∶设ag的粗锌粒中含锌xg
Zn+H2SO4═ZnSO4+H2↑
65 2
X VmL![]() g/L
g/L
![]() =
=![]() ,x=32500pv. 该粗锌粒中锌的质量分数为∶
,x=32500pv. 该粗锌粒中锌的质量分数为∶![]() × 100%=
× 100%=![]() %.
%.
点睛∶本题主要考查酸的性质。