题目内容
【题目】小琦同学设计了如图所示的装置,用于实验室制取CO2,并对它的部分性质进行探究。
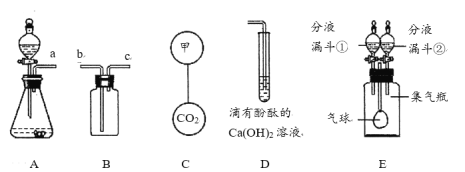
(1)用AB装置制取并收集CO2时,a管口应与_______(选填“b”或“c”)管口相连。
(2)若要使C中的两个气球悬浮在空气中,气体甲可能是_______(填标号)。
a 氢气 b 氧气 c 二氧化碳 d 空气
(3)往D试管中通入CO2,当出现_____________的现象,说明试管内溶质已完全转化为沉淀。
(4)E装置的集气瓶中充满CO2,打开分液漏斗①,滴入少量NaOH浓溶液,气球明显胀大,写出发生反应的化学方程式_______________________________________;若要使气球恢复原状,应关闭分液漏斗①,打开分液漏斗②,滴入___________溶液(填化学式,忽略滴入液体体积)。
【答案】b a 红色变为无色 CO2+2NaOH=Na2CO3+H2O 稀盐酸
【解析】
(1)二氧化碳密度比空气大,所以用B装置收集CO2,气体应从b端通入;
(2)若要C中的两个气球悬浮在空气中,则气体甲可能是氢气,因为氢气的密度比空气小;
(3)根据溶液的酸碱性,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,所以当出现溶液从红色变为无色现象,表示石灰水中的主要成分完全沉淀;
(4)二氧化碳和氢氧化钠反应会生成碳酸钠和水,反应的化学方程式:CO2+2NaOH=Na2CO3+H2O,导致瓶内压强减小,所以气球变化的明显现象是气球膨胀;碳酸盐和酸反应会生成二氧化碳,若要是气球恢复原状,应关闭分液漏斗①,打开分液漏斗②,可以滴入稀盐酸。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】在实验室中化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验称取试剂19.8 g放入锥形瓶中,加入30.2 g的水,充分振荡,再向锥形瓶中依次滴加25 g盐酸充分反应。测得部分数据与图像如下。请根据有关信息回答问题。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
加入盐酸的质量/g | 25 | 25 | 25 | 25 | 25 | 25 |
锥形瓶中物质的质量/g | 75 | 100 | a | 150 | 172.8 | 197.8 |
(1)a的数值为__________,兴趣小组的同学通过实验,得出该试剂已部分变质的结论,其依据是(通过实验数据和图像写出你的分析) _______________________________。
(2)b的数值为____________。
(3)计算该试剂中氢氧化钙的质量分数___________(写出计算过程,结果保留一位小数)。