题目内容
在托盘天平两边各放一只烧杯,调节天平至平衡,在烧杯中分别注入质量相等,质量分数相同的稀硫酸,若在右盘烧杯中投入一定质量的铁恰好完全反应,为使天平仍然平衡,应在左盘的烧杯中投入与铁质量相等的一种金属可能是
- A.Cu
- B.A1
- C.Zn
- D.Mg
BD
分析:A、根据铜和稀硫酸不反应分析.
B、根据铝和稀硫酸反应生成硫酸铝和氢气的化学方程式计算出同质量的稀硫酸消耗铝的质量分析.
C、根据锌和稀硫酸反应生成硫酸锌和氢气计算出同质量的稀硫酸消耗锌的质量分析.
D、根据镁和稀硫酸反应生成硫酸镁和氢气计算同质量的稀硫酸消耗镁的质量分析.
解答:根据质量守恒定律可知只要酸全参加反应产生的氢气就一样多,所以和铁质量相同的金属只要将酸全反应即可.
A、铜和稀硫酸不反应,铁和稀硫酸反应生成硫酸亚铁和氢气,反应后天平会偏向放金属铜的一侧.故A不正确.
B、设和铁反应的稀硫酸中溶质质量为98g,恰好完全反应时铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 98
x 98g
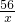 =
=
x=56g
设56g铝全参加反应消耗硫酸的质量为y
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 98
56g y
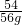 =
=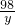
y>98g,所以56g铝和烧杯稀硫酸反应时金属有剩余稀硫酸全反应,所以生成的氢气质量和右盘产生的氢气相同.反应前烧杯中物质质量相等,反应后烧杯中物质质量仍相等.故B正确.
C、设56g锌全参加反应消耗硫酸的质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98
56g z
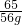 =
=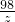
z= ×98g<98g
×98g<98g
所以56g锌和烧杯稀硫酸反应时稀硫酸有剩余,金属锌全参加全反应,所以生成的氢气质量小于右盘产生的氢气的质量,天平向左盘倾斜,故C不正确.
D、设56g镁全参加反应消耗硫酸的质量为a
Mg+H2SO4=MgSO4+H2↑
24 98
56g a
 =
=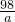
a= ×98g>98g
×98g>98g
所以左盘加入和右盘同样质量的镁时,稀硫酸全参加反应,金属有剩余,生成的氢气和右盘产生的氢气相同,故天平仍然平衡,故D正确.
故答案选BD.
点评:本题考查了过量计算问题,抓住解题的关键是产生氢气的质量是否相等.
分析:A、根据铜和稀硫酸不反应分析.
B、根据铝和稀硫酸反应生成硫酸铝和氢气的化学方程式计算出同质量的稀硫酸消耗铝的质量分析.
C、根据锌和稀硫酸反应生成硫酸锌和氢气计算出同质量的稀硫酸消耗锌的质量分析.
D、根据镁和稀硫酸反应生成硫酸镁和氢气计算同质量的稀硫酸消耗镁的质量分析.
解答:根据质量守恒定律可知只要酸全参加反应产生的氢气就一样多,所以和铁质量相同的金属只要将酸全反应即可.
A、铜和稀硫酸不反应,铁和稀硫酸反应生成硫酸亚铁和氢气,反应后天平会偏向放金属铜的一侧.故A不正确.
B、设和铁反应的稀硫酸中溶质质量为98g,恰好完全反应时铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 98
x 98g
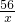 =
=
x=56g
设56g铝全参加反应消耗硫酸的质量为y
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 98
56g y
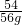 =
=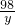
y>98g,所以56g铝和烧杯稀硫酸反应时金属有剩余稀硫酸全反应,所以生成的氢气质量和右盘产生的氢气相同.反应前烧杯中物质质量相等,反应后烧杯中物质质量仍相等.故B正确.
C、设56g锌全参加反应消耗硫酸的质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98
56g z
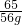 =
=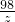
z=
 ×98g<98g
×98g<98g所以56g锌和烧杯稀硫酸反应时稀硫酸有剩余,金属锌全参加全反应,所以生成的氢气质量小于右盘产生的氢气的质量,天平向左盘倾斜,故C不正确.
D、设56g镁全参加反应消耗硫酸的质量为a
Mg+H2SO4=MgSO4+H2↑
24 98
56g a
 =
=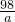
a=
 ×98g>98g
×98g>98g所以左盘加入和右盘同样质量的镁时,稀硫酸全参加反应,金属有剩余,生成的氢气和右盘产生的氢气相同,故天平仍然平衡,故D正确.
故答案选BD.
点评:本题考查了过量计算问题,抓住解题的关键是产生氢气的质量是否相等.

练习册系列答案
相关题目
在托盘天平两边各放一只烧杯,调节至平衡.在两烧杯中分别注入等质量等浓度且足量的稀硫酸,在左烧杯中投入少量的锌粒,在右烧杯中投入相同质量的镁条,锌粒和镁条完全溶解后,天平的指针( )
| A、偏左 | B、偏右 | C、指向中间 | D、无法判断 |
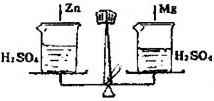
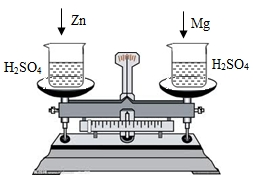 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )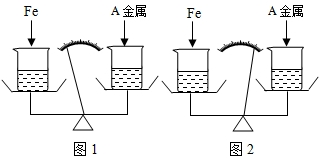 在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )
在托盘天平两边各放一只烧杯,调节至平衡.在两只烧杯里注入相同质量、相同质量分数的足量稀盐酸,然后分别向左右两端烧杯中加入质量相等的Fe和金属A.有气体产生时,天平指针慢慢向左偏转(如图1):指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2).则天平右端加入金属A可能是( )