题目内容
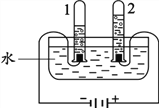
【题目】结合配制溶质质量分数一定的氯化钠溶液的实验图示,回答下列有关问题:

(1)配制200g质量分数为9%的NaCl溶液,需NaCl______g;
(2)在量取水的操作中,当水面接近所需刻度时,应使用______滴加;
(3)操作D中用玻璃棒搅拌的作用是______;
(4)上图操作中,一定能导致溶质质量分数偏小的是______。
【答案】18 胶头滴管 加速溶解 AB
【解析】
(1)配制200g质量分数为9%的NaCl溶液,需NaCl:200g×9%=18g;(2)在量取水的操作中,当水面接近所需刻度时,应用胶头滴管滴加;(3)溶解过程中,搅拌的目的是加速溶质的溶解;(4)称量时物码倒置,则称量的氯化钠的质量减小,会导致溶质质量分数偏小;量取水时仰视,会使量取的水偏多,从而导致溶质质量分数偏小。

 阅读快车系列答案
阅读快车系列答案【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A. 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B. 在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C. 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D. 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素.(实验装置如图1所示,夹持仪器已略去)
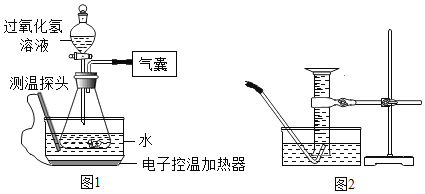
(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类.
(实验记录)同学们进行6组实验,实验记录如表:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | 0.5gNaCl | 0.5gFeCl3 |
60min内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是_____mL.
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定_____来比较过氧化氢的分解速率.
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是_____(填序号).
(4)通过实验①、②、④可得出的结论是_____.
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是_____(答两点).
(6)某同学改用如图2所示装置代替气囊完成实验②,正确的实验操作顺序是_____.
a.将导管伸入量筒,开启控温加热器,滴入过氧化氢溶液
b.开启控温加热器,将导管伸入量筒,滴入过氧化氢溶液
c.开启控温加热器,滴入过氧化氢溶液,待导管口有连续均匀气泡冒出时将导管伸入量筒.