题目内容
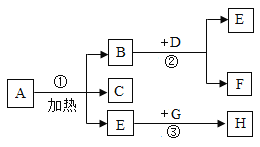
【题目】A、B、C、D、E是初中化学常见的物质它们之间的转化关系如下图1所示部分反应条件、反应物及生成物已略去。图2所示的是A、B、D、E的相关信息(重叠部分表示两种物质的共同点) 请回答下列间题:
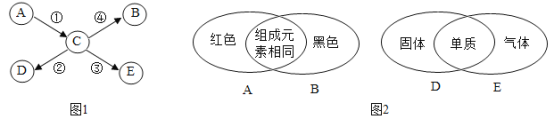
(l)A、B的化学式分别是_________、__________;
(2)物质C的用途______。
(3)反应③反应④的化学方程式分别____________;_________________
(4)要实现反应①的转化还需要一种具有___________性的反应物。
【答案】Fe2O3 Fe3O4 炊具(合理即可) Fe+2HCl=FeCl2+H2↑ 3Fe+2O2 ![]() Fe3O4 还原性
Fe3O4 还原性
【解析】
A、B、C、D、E是初中化学常见的物质,A、B组成元素相同,A是红色固体,B是黑色固体,结合常见的红色固体有:氧化铁、红磷、铜等,猜想A是氧化铁,B是四氧化三铁,氧化铁转化成的C会生成四氧化三铁,氧化铁与一氧化碳反应生成铁和二氧化碳,铁在氧气中燃烧燻成四氧化三铁,C可以是铁,D是固体单质,E是气体单质,铁会生成D和E,铁和硫酸铜反应生成硫酸亚铁和铜,铁和硫酸反应生成硫酸亚铁和氢气,D可能是铜, E可能是氢气,,经过验证,猜想正确。
根据以上分析可知:
(1)A、B的化学式分别是:Fe2O3、Fe3O4;
(2)通过推导可知,C是铁,物质C的用途之一为:制作炊具;
(3)反应③是铁和盐酸反应生成氯化亚铁和氢气,反应④是铁和氧气在点燃的条件下生成四氧化三铁,化学方程式分别为:Fe+2HCl=FeCl2+H2↑,3Fe+2O2 ![]() Fe3O4;
Fe3O4;
(4)反应①是氧化铁转化为铁,要实现转化,还需要一种能夺取氧化铁中氧元素的物质,具有还原性的反应物。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现有25g石灰石样品,请按下面要求计算
(1)25g样品与足量的稀盐酸反应放出8.8gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少?_____
(2)若将25g样品平均分成两份,分别加工成块状和粉末状,将两份样品分别放入锥形瓶中,同时加入相同体积,相同浓度的足量稀盐酸充分反应,请在图象上画出块状样品与稀盐酸反应放出CO2的曲线示意图。_____
(3)若将一定质量的该石灰石样品高温煅烧,有关物质质量反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_____,t3时剩余固体中除杂质外含有的物质是_____(填化学式)