��Ŀ����
����Ŀ����ȤС���ͬѧΪ�˲ⶨijʯ��ʯ��Ʒ��CaCO3����������������ȡʯ��ʯ��Ʒ��������ȡ12.5g��������Ϊ20g���ձ��У��ټ���73g������ϡ���ᣨ���ʲ���Ӧ��������ˮ�ֻӷ�����ÿ��һ��ʱ���õ��ӳӳƳ��ձ����������ʵ���������¼���±���
ʱ�� | t1 | t2 | t3 | t4 | t5 | t6 |
�ձ�������/g | 103.3 | 101.8 | 101.3 | 101.1 | 101.1 | m |
��1��CaCO3�и�Ԫ�صİٷֺ���Ϊ______��
��2������m=______����Ӧ��������������̼______g��
��3������ʯ��ʯ��Ʒ��̼��Ƶ����������Ƕ��٣�____
���𰸡�40% 101.1 4.4 80%
��������
�⣺��1��CaCO3�и�Ԫ�صİٷֺ���Ϊ��![]() =40%��
=40%��
��2���ɱ��е����ݿ�֪����Ӧ���е�t4ʱ�ձ����������ʵ��������ٱ仯��˵����̼�������ȫ�����˷�Ӧ����m=101.1g����������������Ϊ���ɶ�����̼�������������ɵĶ�����̼������Ϊ��12.5g+20g+73g-101.1g=4.4g��
��3����̼��Ƶ�������x,
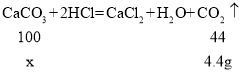
![]()
��ã�x=10g
���ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ![]() =80%��
=80%��

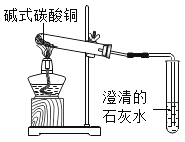
 �ŵ������ϵ�д�
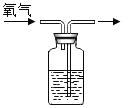
�ŵ������ϵ�д�����Ŀ��ʵ����ͨ��������ͼװ����ȡ������
д��KClO3��MnO2��������ȡ�����Ļ�ѧ����ʽ______��
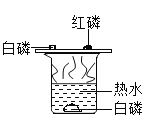
ij��ѧ��ȤС����ʵ������з������������쳣������
a�������ſշ��ռ���������ζ��
b������״MnO2��ø�ϸ��
�Դ˽���������̽����
̽��(I)�����ſշ��ռ�����������ζ
�������ϣ�KClO3��MnO2�����·ֽ�����������������������������
��2KClO3+2MnO2![]() 2______+Cl2��+O2��
2______+Cl2��+O2��
��2KMnO4![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
��Cl2+K2MnO4![]() 2KCl+MnO2+O2����
2KCl+MnO2+O2����
(1)д���������ʵ�����______������MnԪ�صĻ��ϼ�Ϊ______��
(2)�²��������ſշ��ռ���������ζ����������______��
̽��(��)����״MnO2��ø�ϸ
ѧϰС��ͨ�����۲²⣺����ΪMnO2Ҳ�μ��˻�ѧ��Ӧ��С��ͬѧ��ͬ���ʵ�鲢��֤MnO2�ڸ÷�Ӧ����������
ʵ����� | ʵ������ | ���� | |
ʵ��һ | ��KClO3�������ڻ�����������ǵ�ľ���� | ľ��һ��ʱ���ȼ | KClO3����Ҫ�ֽ���������� |
ʵ��� | ����MnO2����������ǵ�ľ�� | ______ | MnO2���Ȳ����������� |
ʵ���� | ȡ��KClO3��2g�� ______ | ľ��Ѹ�ٸ�ȼ | MnO2 ______ (�����ӿ�������������)KClO3�ķֽ� |
ʵ����ۣ�MnO2��KClO3���ȷֽ�Ĵ�����
���ɷ�˼����С���ʵ������ܵ�����С������ɣ�Ϊ�˸�С���ֲ�������ʵ�飺
(1)���Թ���ȫ��ȴ����ʵ�������Թ��м�����ˮ���������ȫ��ת�����ձ�������(MnO2������ˮ���������ʾ�������ˮ)��ϴ�ӳ�������ɣ�������Ŀ������֤______���������ù�������______��
(2)���ʵ����֤��������һ���ص㣬ʵ�鷽��______��
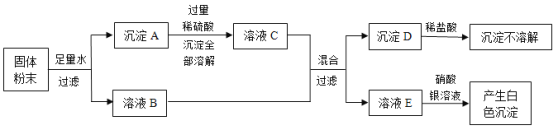
����Ŀ����������ͭ�dz��������ֽ�����ͬѧ�Ƿ��������е�����Ʒ��ͭ��Ʒ����һ�㲻�÷��⣬������Ʒһ����Ҫ���������
��������⣩���Dz�����Ϊ��������ͭ���ֽ��������Ļ����ǿ�أ�
��ʵ��̽����ͬѧ�Ƕ������ֽ����Ļ��˳��չ����̽�����������̽������д�ո���ϸ��ͬ����˿����˿��ͭ˿�ֱ����ϡ�����С�
�� �� |
|
|
| ��������ó��������˳�� |
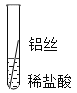
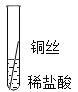
Ƭ�̺������ | ���������� | ������ | ������ | Fe��Al��Fe��Cu |
�����Ӻ������ | ���������� | �д������� | ������ | _____ |
�����۽�����Ϊʲôͬһ��ʵ��ó������ֽ����أ�ͬѧ�Ǵ���������ʲ�����������ϣ���������˿��ϡ�����ж�ʱ���������ݣ�����Ϊ���������ܵ�����Ĥ���������ᷴӦ��
����˼���ۣ��ڸ�ʵ����Ҫ�����Ҫ��ͬ��ϸ��ϡ����Ҫ_____��
���轫�������д�ĥ����ĥ��Ŀ����_____��
��ʵ����֤��Ϊ�˽�һ��ȷ����������ͭ�����ֽ����Ļ��˳��ͬѧ���ֽ�������ϸ��ͬ�ġ���ĥ������˿�ֱ������������Һ������ͭ��Һ�У�
���� |
|
| ��������ó��������˳�� |
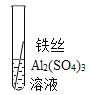
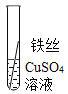
���� | ���������� | _____�� | Al��Fe��Cu |
д����������ͭ��Һ��Ӧ�Ļ�ѧ����ʽ_____��
����չǨ�ƣ�
��1��ʵ���������ʦ�����ܽ�����֤��������ͭ�����ֽ����Ļ��˳������ַ���������������б�ķ���Ҳ������֤��������ͭ�����ֽ����Ļ��˳�����ֱ���˿��ͭ˿����_____��Һ�У��ѧʽ�����۲�������֪��������ͭ�������ֽ����Ļ��˳���������뷨�õ��˴��һ����ͬ��
��2������������������֤�����Ļ��˳����������_____�����жϡ�