��Ŀ����
����Ŀ��С��ͬѧ��Ҫͨ��ʵ��֤�������������ܼӿ�����طֽ���������Ʋ�������±���ʾ��̽��ʵ�飺
(1)�����С��ͬѧ��д�ϱ���δ����Ŀո�
ʵ����� | ʵ������ | ʵ����� | �ܽ� | |
ʵ��һ | ȡ������������Թ��У����������ڣ���������ǵ�ľ�� | ľ���ӽ��Թܵײ���������ȼ | ��������ز������������Ƿ�Ӧ�����¶�_______ | ���������ܼӿ�����طֽ� |
ʵ��� | ȡ���������������Թ��У����ȣ���������ǵ�ľ�� | û���������� | _________ | |
ʵ���� | ______���ȣ���������ǵ�ľ�� | __________ | ���������ܼӿ�����صķֽ⣬��Ӧ�����ֱ���ʽΪ___________ |
(2)��С����̽��ʵ���У���ʵ��һ������ʵ��������������___
(3)СӢͬѧ��һ��ʵ���з�����������м��������ĸ������Ҳ�ܼӿ���ֽ⣬����Ϊԭ����____
(4)Ҫ֤����������������طֽ�Ĵ���������Ҫ��֤�Ķ��������ڷ�Ӧǰ��____��____�������ı�
�����ʵ����֤����ͭ�ǹ�������ֽ�Ĵ�����д��ʵ�������Ԥ�ڵ�ʵ������
ʵ����� | ʵ������ |
___________________ | ________________ |
���𰸡� �ϸ� ���ȶ������̲��������� ȡ��������غͶ������̵Ļ�������Թ��У����� ��������ǵ�ľ�� ľ�����Թܿڸ�ȼ �����![]() �Ȼ���+���� ���� ������ص��������ɶ������̣���������������ط�Ӧ�Ĵ��� ���� �������10����ѧ����
�Ȼ���+���� ���� ������ص��������ɶ������̣���������������ط�Ӧ�Ĵ��� ���� �������10����ѧ����
ʵ����� | ʵ������ |
ȡ�����Թܱ��Ϊ�����ڣ�����֧�Թ��зֱ�����Ũ�ȵ�����Ĺ���������Һ�������Թܢ��м�������Ϊa g������ͭ���壬�������ǵ�ľ���ֱ�����Թ��ڣ����ù۲����� | �Թܢ��������������Թܢ��ڲ����������ݣ������ǵ�ľ���ܿ츴ȼ |
������ʵ�鷴Ӧ��ȫ���Թܢ��ڵ�ʣ������ˣ�ϴ�ӣ���ɣ����� | ����������Ϊa g |
�����������ʵ��̽����������������طֽ�ʵ���е����ã�ͨ�����Ʊ���������̽����ʵ��һ��ֻ��������������ڣ�̽���Ƿ��������������������������ʵ���ֻ���ȶ������̣�̽���Ƿ����������ʵ����̽���������̺�����ػ�������̽���Ƿ�����������Դ�Ϊ�ݽ���⡣
��1��ʵ��һ�м��������������״̬��������ľ���ڿ����Թܵײ�ʱ��ȼ��˵���ڸ��������£�����طֽ�����������������٣�ʵ�����ֻ���ȶ������̣�û����������˵���������̼��������²���ֽ����������ʵ����Ӧȡ��������غͶ������̹����������Թ��У����ȣ��������ǵ�ľ�������Թ��ڣ�ľ�����Թܿڴ����ɸ�ȼ����Ӧ�����ֱ���ʽΪ�������![]() �Ȼ���+�������ʴ�Ϊ���ϸߣ����ȶ������̲�����������ȡ��������غͶ������̵Ļ�������Թ��У����ȣ�ľ�����Թܿڸ�ȼ�������
�Ȼ���+�������ʴ�Ϊ���ϸߣ����ȶ������̲�����������ȡ��������غͶ������̵Ļ�������Թ��У����ȣ�ľ�����Թܿڸ�ȼ�������![]() �Ȼ���+������
�Ȼ���+������
��2��ʵ��һ��ʵ����Ĺ�����ҪΪ��̽���ֱ�ֻ��������ء��������̣��۲��Ƿ���������ʹ�����ǵ�ľ����ȼ����ͨ������ʵ����գ�֤����������������طֽ������������ã��ʴ�Ϊ�����գ�
��3������������ȷֽ��������غͶ������̺������������Ķ������̿ɴٽ�����طֽ⣬�ʴ�Ϊ��������ص��������ɶ������̣���������������ط�Ӧ�Ĵ�����
��4������ָ�ڻ�ѧ��Ӧ�пɸı仯ѧ��Ӧ���ʣ��������������ͻ�ѧ���ʲ�������ʣ�����������Ϊ����طֽ�Ĵ�������������طֽⷴӦ�У������������ͻ�ѧ���ʲ��ı䣬�ʴ�Ϊ����������ѧ���ʣ�
��5����Ҫ֤������ͭ�ڹ�������ķֽ���������ã���Ӧ���տ��Ʊ��������ʵ��֤����ʵ��������£�
ʵ����� | ʵ������ |
ȡ�����Թܱ��Ϊ�١��ڣ�����֧�Թ��зֱ�����Ũ�ȵ�����Ĺ���������Һ�������Թܢ��м�������Ϊa g������ͭ���壬�������ǵ�ľ���ֱ�����Թ��ڣ����ù۲����� | �Թܢ��������������Թܢ��ڲ����������ݣ������ǵ�ľ���ܿ츴ȼ |
������ʵ�鷴Ӧ��ȫ�������Թܢ��ڵ�ʣ������ˣ�ϴ�ӣ���ɣ����� | ����������Ϊa g |

����Ŀ��̽��ѧϰС����ʵ��������ͼ1��ʾװ����ȡCO2��̽��CO2���������(Na2O2)�ķ�Ӧ��
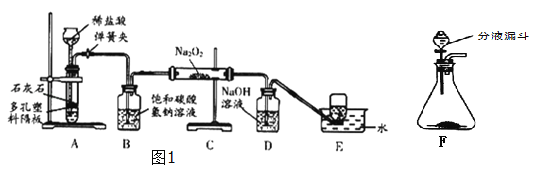
�������ϵ�֪����������(Na2O2)��һ�ֵ���ɫ���壬����CO2��H2O������Ӧ��Na2O2+2CO2�T2Na2CO3+O2��2Na2O2+H2O�T4NaOH+O2��
��ش��������⣺
(1)װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ________________________������װ��A��ȡCO2���ŵ���___________________________________��
(2)װ��B������������CO2�л��е�HCl��������Ӧ��ѧ����ʽΪ____________________________
(3)װ��D��������_______________________��
(4)װ��E���ռ�����������____(�ѧʽ)�������廹����������ͼ2װ���е�______�����ռ�(��д��ĸ���)��
(5)Ϊ̽����Ӧ��װ��CӲ�ʲ������й���ijɷ֣���С��ͬѧ��������ͼ3ʵ�飺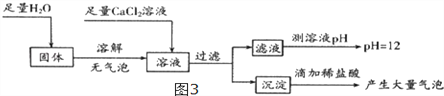
���ݹ����ˮ�ܽ������ݣ��ó�__________________________���ۣ����������Ȼ���Ŀ��Ϊ
_______________________________________�������жϣ���Ӧ��װ��CӲ�ʲ������й���Ϊ
______________________��
(6)����ʵ������ȡ������̼���о��У�̽��ѧϰС���ֽ���������ʵ�飺
ҩƷ��� | �� | �� | �� | �� |
����ʯ | m g����״ | m g����״ | m g����ĩ״ | m g����ĩ״ |
����(����) | w g��ϡ���� | w g��Ũ���� | w g��ϡ���� | w g��Ũ���� |
I.��Ҫ�о�����Ũ�ȴ�С�Է�Ӧ��Ӱ�죬��ѡ��ʵ�����______����(ѡ��ʵ����)��
II..�������Ũ���⣬����ʵ���о�����һ��Ӱ�췴Ӧ��������_____________________��
III.�о��������Ũ��Խ����������ٶ�Խ�죬��ױȽϣ��Զ�������ȷ����______(ѡ����)
A����Ӧ��Ϊ���� B������ʣ����Һ��������С
C�������Ķ�����̼���������� D����ĩ״����ʯ�����ʸ���
���±��е�����ʵ�飬������ԭ��״̬������װ�õȷ�����ڲ��죬ȴ���ܿ��������ƽ�ȵز��������ʵ��Ŀ�ġ�ԭ����ԭ�ϡ�װ�á������ȷ���˼���������ÿ��ʵ���������ƽ�Ȳ���������Ҫ��һ��ԭ��
Ŀ�� | ԭ�� | ����װ�� | �����ƽ�Ȳ����� ����Ҫ��һ��ԭ�� |
��ȡ������̼ | ��״����ʯϡ���� | A | ______________________ |
��ȡ���� | ��ĩ״������̼3%�Ĺ���������Һ | F | ________________________ |