题目内容
(2012?潍坊)某同学模拟工业炼铁原理,用如图所示装置进行实验.取8g氧化铁,通入足量一氧化碳,充分反应后,冷却,将玻璃管中的固体移入盛有49g硫酸溶液的烧杯中,恰好完全反应.
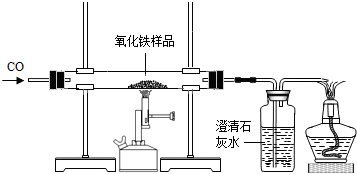
(1)该同学首先按如图所示装配好仪器,检查了气密性并装好仪器,接下来的操作是
(2)计算硫酸溶液的溶质质量分数(要求写成计算推理过程).

(1)该同学首先按如图所示装配好仪器,检查了气密性并装好仪器,接下来的操作是
先通一段时间的一氧化碳
先通一段时间的一氧化碳
(只写一步即可).(2)计算硫酸溶液的溶质质量分数(要求写成计算推理过程).
分析:(1)根据一氧化碳的性质进行分析、填空;
(2)根据一氧化碳还原氧化铁的原理书写化学方程式,由该方程式找到氧化铁和铁单质间的数量关系可以求得单质铁的质量;然后由铁与稀硫酸反应的方程式找出铁与稀硫酸间的数量关系.
(2)根据一氧化碳还原氧化铁的原理书写化学方程式,由该方程式找到氧化铁和铁单质间的数量关系可以求得单质铁的质量;然后由铁与稀硫酸反应的方程式找出铁与稀硫酸间的数量关系.
解答:解:(1)通入一氧化碳,其目的是排尽玻璃管内的空气,防止加热时因一氧化碳不纯而引起爆炸;
故填:先通一段时间的一氧化碳.
(2)设8g氧化铁完全反应后生铁的质量为x.
Fe2O3+3CO
2Fe+3CO2
160 112
8g x
=
x=5.6g
设5.6g铁消耗硫酸的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 98
5.6g y49
=
y=9.8g
硫酸溶液的溶质质量分数为:
×100%=20%
答:硫酸溶液的溶质质量分数为20%.
(其它解答推理过程,只要合理即得分,但必须有关的化学方程式或对分析过程的描述,只列出一个或几个代数式不得分.)
故填:先通一段时间的一氧化碳.
(2)设8g氧化铁完全反应后生铁的质量为x.
Fe2O3+3CO
| ||
160 112
8g x
| 160 |
| 112 |
| 8g |
| x |
x=5.6g
设5.6g铁消耗硫酸的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 98
5.6g y49
| 56 |
| 98 |
| 5.6g |
| y |
y=9.8g
硫酸溶液的溶质质量分数为:
| 9.8g |
| 49g |
答:硫酸溶液的溶质质量分数为20%.
(其它解答推理过程,只要合理即得分,但必须有关的化学方程式或对分析过程的描述,只列出一个或几个代数式不得分.)
点评:通过回答本题知道了炼铁的反应原理,并进一步熟悉了利用方程式进行计算的方法.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目

 (2012?潍坊)清新的空气、洁净的水、均衡的营养都与人体健康息息相关.请你利用所学化学知识回答下列问题:
(2012?潍坊)清新的空气、洁净的水、均衡的营养都与人体健康息息相关.请你利用所学化学知识回答下列问题: