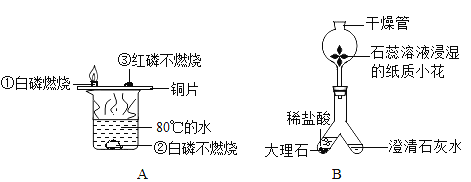
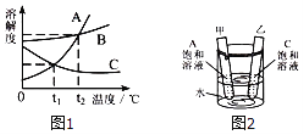
题目内容
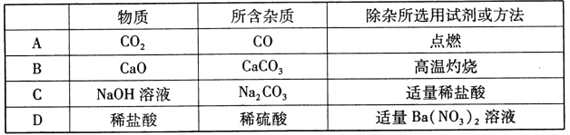
【题目】A、B、C、D、E、F、G、H为常见的物质,其中B、E、G属于单质,H是制碳酸饮料的气体,C是由地壳中含量最多的元素组成的单质,右图是它们之间的相互转化关系,部分反应物、生成物及反应条件略去。
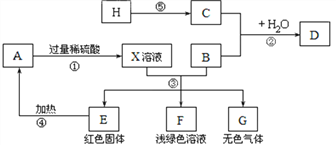
请回答:
(1)固体D主要成分的化学式为_______,无色气体G的名称______, X溶液中所含有的溶质为_______(写化学式)。
(2)写出反应①、④、⑤的化学方程式:①______;④_____;⑤______。
(3)写出反应③中生成红色固体的化学方程式_______。
【答案】 Fe2O3 氢气 CuSO4、H2SO4 CuO+H2SO4=CuSO4+H2O 2CuO+O2 ![]() 2CuO 6CO2+6H2O
2CuO 6CO2+6H2O![]() C6H12O6+6O2 Fe+CuSO4=FeSO4+Cu
C6H12O6+6O2 Fe+CuSO4=FeSO4+Cu
【解析】本题是推断题。在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
H是制碳酸饮料的气体,H是二氧化碳;C是地壳中含量最多的元素组成的单质,C是氧气;红色固体E加热生成A, E可能是铜,A是氧化铜;氧化铜与过量的硫酸反应得到的X溶液含有硫酸铜和硫酸,与B反应生成浅绿色的溶液F,F是硫酸亚铁,G是氢气,B是铁;铁与氧气和水能反应生成铁锈;代入框图,假设合理。因此:
(1)固体D铁锈,主要成分是氧化铁,化学式为Fe2O3,无色气体G是氢气, X溶液中所含有的溶质为硫酸铜和硫酸,化学式为:CuSO4、H2SO4;
(2)反应①是氧化铜与硫酸反应生成硫酸铜和水,反应的化学方程式是:CuO+H2SO4=CuSO4+H2O;反应④是铜与氧气在加热时生成氧化铜,反应的化学方程式是:2CuO+O2 ![]() 2CuO;反应⑤是二氧化碳能与水在光和叶绿素的作用下反应生成氧气和葡萄糖,化学方程式是:6CO2+6H2O
2CuO;反应⑤是二氧化碳能与水在光和叶绿素的作用下反应生成氧气和葡萄糖,化学方程式是:6CO2+6H2O![]() C6H12O6+6O2;
C6H12O6+6O2;
(3)反应③中生成红色固体的反应是铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式Fe+CuSO4=FeSO4+Cu。

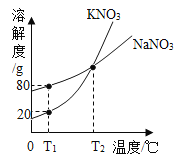
【题目】下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究.请回答下列问题:
[提出问题1]: 该氢氧化钠固体有没有变质呢?
[进行实验1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到_________________,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.
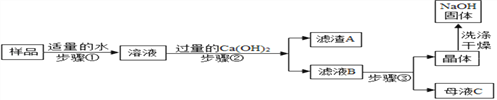
[实验分析]:
⑴步骤②反应的化学方程式是____________,步骤②的操作有搅拌和过滤,搅拌的作用是_______.
⑵证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是_________.
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
⑶为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、_________、过滤. A.蒸发结晶B.降温结晶
⑷丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是_______________.
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质
[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
样品溶液质量(g) | 10 | 20 | 30 | 40 |
氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
⑸表中第_________次恰好完全反应.
⑹请计算样品中氢氧化钠的质量分数为_____________?(请写具体解题过程)