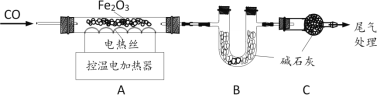
题目内容
【题目】一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( )
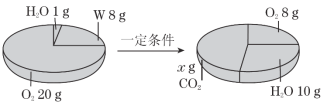
A. x的值为22
B. 该反应中的生成物是CO2、H2O和O2
C. W由碳、氢两种元素组成
D. W中碳、氢元素原子个数比为1∶4
【答案】D
【解析】
反应后质量增多的物质是生成物,质量减少的物质是反应物,反应后出现的新物质是生成物。根据反应前后物质的差量可知,反应是W+O2→H2O+CO2。参加反应的W的质量是8g,参加反应的O2的质量是:20g-8g=12g,生成水的质量是10g-1g=9g。A. 根据质量守恒定律,x的值为:8g+12g-9g=11g,此选项错误;B. 该反应中的生成物是CO2、H2O,此选项错误;C.反应前后各元素的种类和质量不变,W中一定含有碳、氢元素,11gCO2中碳元素的质量是:11g×![]() =3g,9gH2O中氢元素的质量是:9g×
=3g,9gH2O中氢元素的质量是:9g×![]() =1g,碳元素与氢元素是质量之和是:3g+1g=4g,而参加反应的W的质量是8g,所以W中除含有碳元素、氢元素之外,一定含有氧元素,所含氧元素的质量为:8g-4g=4g,此选项错误;D. W中碳、氢元素原子个数比为:
=1g,碳元素与氢元素是质量之和是:3g+1g=4g,而参加反应的W的质量是8g,所以W中除含有碳元素、氢元素之外,一定含有氧元素,所含氧元素的质量为:8g-4g=4g,此选项错误;D. W中碳、氢元素原子个数比为:![]() :
:![]() =1∶4,此选项正确。故选D。
=1∶4,此选项正确。故选D。

练习册系列答案
相关题目