题目内容
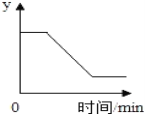
【题目】利用数据传感技术比较铁丝和铁粉与足量稀盐酸反应的快慢。按下图装置进行实验,倾斜锥形瓶,使10mL稀盐酸与固体充分接触,瓶内气压随时间的变化如图所示。

(1)m=_____________。
(2)反应的化学方程式是_____________。
(3)图中 d点溶液中溶质为_____________ (填“化学式”)。
(4)对比 a、c 点,能说明铁粉较铁丝反应更快的理由是_____________。
(5)t秒内,铁粉比铁丝与稀盐酸反应产生的氢气_____________ (填“多”或“少”)
(6)某反应前后分子变化的微观示意图如图。
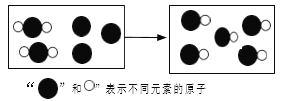
①反应物与生成物共有_____________种物质。
②该反应的基本类型是_____________反应。
【答案】2g Fe+2HCl=FeCl2+H2↑ HCl、FeCl2 生成相同量的氢气铁丝较铁粉用时长(合理即可) 多 三 化合
【解析】
(1)因为本实验目的是比较铁丝和铁粉与足量盐酸反应的快慢,只需控制“铁丝“和”铁粉“一个变量”,所以m= 2g,故填“2g”;
(2)铁与盐酸反应生成氯化亚铁和氢气,所以反应方程式为Fe + 2HCl= FeCl2 + H2↑;
(3)分析图像可知由于d点对应的压强没有达到最大值,说明反应没有进行完,则d点对应溶液中的溶质有剩余的HCl和生成的FeCl2,故填“HCl、FeCl2”;
(4)分析图像中a、c点所对应的坐标可知产生相同压强即生成等质量的氢气,铁丝比铁粉需要的时间长,所以填“生成相同量的氢气铁丝较铁粉用时长”;
(5)分析图像可知在t秒内“铁粉”的曲线一直在“铁丝曲线”的上方,也就是说相同时间铁粉与盐酸反应产生的氢气多,故填“多”;
(6)分析反应前后微观模型图可知,反应前有两种微粒,反应后是一种微粒。所以反应物与生成物共有三种物质,故填“三”,反应类型为化合反应,故填“化合反应”。

 名题金卷系列答案
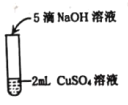
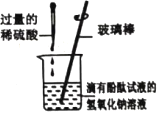
名题金卷系列答案【题目】某兴趣小组在实验室中探究氢氧化钠的性质,请你参与探究并填空
(实验过程与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | _____ | _____ | 溶液由红色变为无色 |
实验分析 |
|
| 该中和反应实质是_____ |
实验结论 | _____ | _____ | 氢氧化钠能与硫酸发生反应 |
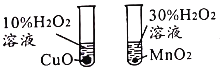
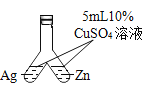
【题目】控制变量是实验探究的重要方法。下列实验设计能达到实验目的的是![]()
|
|
|
|
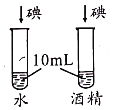
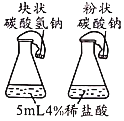
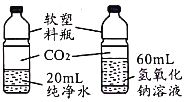
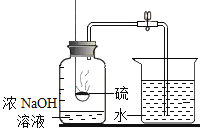
A.探究催化剂的种类对反应速率的影响 | B.探究不同溶剂中物质溶解性大小 | C.比较物质与稀盐酸反应的快慢 | D.证明二氧化碳和氢氧化钠发生了反应 |
A.AB.BC.CD.D